��2013?��ģ�⣩�Ի�ѧ��Ӧ���о���Ҫ�ӷ�Ӧ�������ȡ����ʡ�������ϵ�����ؽ����ۺϷ����������ǹ��ڻ�ѧ��Ӧ��ϵ���о�������������Ϣ�ش����⣮
I�����ڷ�Ӧ��֮��Ķ�����ϵ���о���
��1����֪��Ӧ��2I
-+2Fe
3+=I
2+2Fe
2+����100mL��0.1moL?L
-1��FeI
2��Һ��ͨ��0.01mol Cl
2���÷�Ӧ�����ӷ���ʽΪ
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
��
��2��298Kʱ��Mg��OH��
2���ܶȻ�����Ksp=5.6��10
-12�������ʵ���Ũ�Ⱦ�Ϊ2��10
-4mol?L
-1���Ȼ�þ��Һ������������Һ�������ϣ��ܷ����������þ������
��
��
����ܡ�����
���ڷ�Ӧ���ʡ��ȵ��о���
����ʱ�䣬ȫ����Χ�ڵ�������������Ӱ�������ǵ����彡������������Խ��Խ�ܵ����ǵ����ӣ�����β���к��н϶��NO��CO�������������ʹ�����ж�����COΪ�������ж�ԭ������ͬ�¶���CO��Ѫ�쵰�Ľ������ԶԶ����������Ѫ�쵰�Ľ����������Ӧ���£�CO+HbO
2?O
2+HbCO��HbO
2��ʾ����Ѫ�쵰�ף���
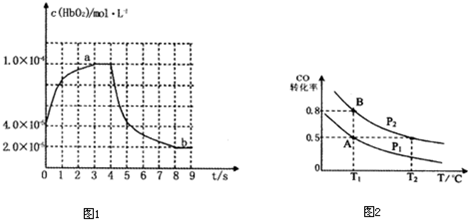
��ͼ��ʾHbO
2Ũ����ʱ��ı仯������a��ʾ��Ѫ����ͨ��������ı仯������b��ʾ�ڵ�4sʱͨ��CO��O
2��������ı仯��
��3��ǰ3s��HbO
2��ʾ��ƽ����Ӧ����Ϊ
2��10-5mol/��L?s��
2��10-5mol/��L?s��
����9sʱ��HbCO��Ũ��Ϊ
8��10-5
8��10-5
mol?L
-1��
��4��37��ʱ��CO+HbO
2?O
2+HbCO���÷�Ӧ��ƽ�ⳣ��K=220��������ʾHbCO��Ũ�ȴﵽHbO
2Ũ�ȵ�0.022�����ͻᵼ�������������𣮾ݴˣ�ͨ�������֪���������CO��O
2Ũ��֮�ȴ��ڻ����
ʱ���˵����������ܵ��˺���
��5��һ����̼������������Ҫ����Դ��Ҳ���Դ���ԭNO��������Ⱦ����������һ����������ȡCH
3OH����֪
N
2��g��+O
2��g��=2NO����g����H=+180.5kJ?mol
-12H
2��g��+O
2��g��=2H
2O��1����H=-571.6kJ?mol
-1H
2O��g��=H
2O��1����H=-44kJ?mol
-1�H
2��NO��Ӧ����N
2��ˮ�������Ȼ�ѧ����ʽ
2H2��g��+2NO��g��=2H2O��g��+N2��g����H=-664.1kJ/mol
2H2��g��+2NO��g��=2H2O��g��+N2��g����H=-664.1kJ/mol
��
��6����һ�ݻ��ɱ���ܱ������г���10mol CO��20molH
2���ڴ�������ʱ��Ӧ���ɼ״���CO��g��+2H
2��g��?CH
3OH��g����CO��ƽ��ת�������¶ȣ�T����ѹǿ��P���ı仯����ͼ��ʾ�����ﵽƽ��״̬Aʱ�����������Ϊ10L���練Ӧ��ʼʱ�Գ���10mol CO��20mol H
2������ƽ��״̬Bʱ���������V��B��=
2
2
L��

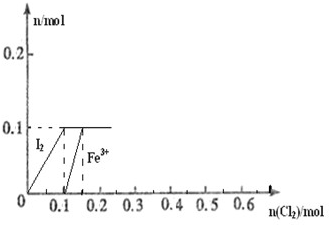 ��100mL FeI2��Һ����ͨ��Cl2������������Cl-��I2��Fe3+��IO3-������Fe3+��I2�����ʵ�����n��Cl2���ı仯��ͼ��ʾ����ش��������⣺
��100mL FeI2��Һ����ͨ��Cl2������������Cl-��I2��Fe3+��IO3-������Fe3+��I2�����ʵ�����n��Cl2���ı仯��ͼ��ʾ����ش��������⣺

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
