
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】“84消毒液”在日常生活中被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用。已知,强酸弱碱形成的盐溶液呈酸性,则你认为“84消毒液”的有效成分是( )
A. 氯化氢 B. 次氯酸钠 C. 高锰酸钾 D. 碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的离子积:25℃时Kw=1×10﹣14,100℃时Kw=1×10﹣12。试回答以下问题.
(1)25℃时,某Na2SO4溶液中c(SO42﹣)=5×10﹣4 molL﹣1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH﹣)=_________.
(2)在100℃时,测得某溶液pH=7,该溶液显_________(填“酸”、“碱”或“中”)性.
(3)将100℃温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=________.
(4)某温度时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=________。
①该温度下( T ℃),将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=____________。
②该温度下(T ℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A. 常温常压下,48gO2含有的氧原子数为3NA
B. 1.7g NH3含有的质子数为NA
C. 标准状况下,11.2L氦气和氢气的混合气含有的分子数为0.5NA
D. 1L 0.1 mol/LCH3CH2OH水溶液中含H原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 质量相等的O2和O3中所含原子数相等
B. 物质的量相等的O2和O3中含分子数相等
C. 质量相等的CO和CO2中所含碳原子数相等
D. 物质的量相等的CO和CO2中含碳原子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排放的废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性小组利用这种废液来制取较纯净的氯化钾晶体及液溴,他们设计了如下的流程(提示:图中试剂a的作用是将Br-转化为Br2)
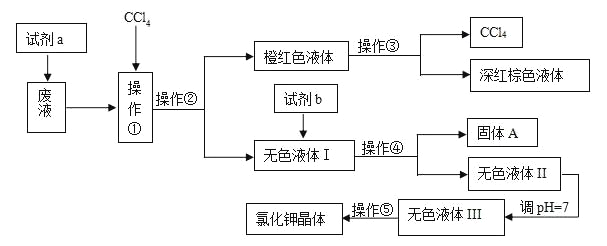
试剂b需要从以下试剂中选择:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸
(1)操作①②③④⑤的名称是________(填序号)。
A. 萃取、过滤、分液、过滤、蒸发结晶
B. 萃取、分液、蒸馏、过滤、蒸发结晶
C. 分液、萃取、过滤、过滤、蒸发结晶
D. 萃取、分液、分液、过滤、蒸发结晶
(2)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42-,选出试剂b(试剂b代表一组试剂)所代表的试剂,按滴加顺序依次是_____________________________________________________________。
(3)调节pH=7的作用是________________________________________,所用的试剂是___________(填名称)
(4)操作⑤中用到的瓷质仪器名称是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A. 浓度均为0.1 mol·L-1的氨水和盐酸等体积混合后:c(H+)=c(OH-)+c(NH3·H2O)
B. 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO![]() )<c(HCO
)<c(HCO![]() )
)
C. 在NaHB溶液中一定有:c(Na+)=c(HB-)+2c(B2-)
D. Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:
盐碱地产生碱性的原因:__________________________________________;
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(5)已知:常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;则 NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com