
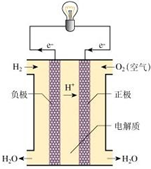
| A. | 通入 H2电极是负极 | |
| B. | 通入 O2电极发生氧化反应 | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定没有甲烷 | B. | 一定没有乙烷 | ||
| C. | 可能是甲烷和丙烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的通式为 RH5 | B. | 最高化合价是+5 价 | ||
| C. | 非金属性由上到下递增 | D. | 其最高价含氧酸均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
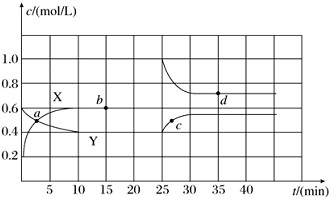
 对于密闭容器中可逆反应A2(g)+3B2(g)?2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
对于密闭容器中可逆反应A2(g)+3B2(g)?2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )| A. | 加入催化剂可以使状态d变为状态b | |
| B. | 若T1>T2,则逆反应一定是放热反应 | |
| C. | 达到平衡时A2的转化率大小为:b>a>c | |
| D. | 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①③均发生了置换反应 | B. | 步骤③中SO2被还原 | ||
| C. | 步骤②③的目的是富集溴元素 | D. | 步骤④利用了溴易挥发的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com