
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
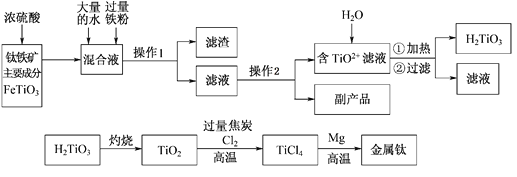
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有________________________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_____________________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是___________________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是_____________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是________________________________________________。
【答案】漏斗、玻璃棒 溶液中存在平衡:TiO2++2H2O ![]() H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na
H2TiO3+2H+,当加入水稀释、升温后,平衡正向移动 TiCl4+4Na![]() Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色
Ti+4NaCl TiO2 + 4e- = Ti + 2O2- 酸式滴定管 溶液由无色变成红色且半分钟不褪色
【解析】
(1)操作1为过滤,用到的玻璃仪器除烧杯外还有,玻璃棒、漏斗;
(2)TiO2+在溶液中会发生水解反应TiO2++2H2O ![]() H2TiO3+2H+,加水稀释并加热含TiO2+的溶液,会使TiO2+的水解不断正向移动;
H2TiO3+2H+,加水稀释并加热含TiO2+的溶液,会使TiO2+的水解不断正向移动;
(3)若要还原四氯化钛,则需选择金属活动性强于钛的金属来代替镁,因此在三种金属中只能选择Na,反应方程式为TiCl4+4Na![]() Ti+4NaCl;
Ti+4NaCl;
(4)阴极上TiO2得电子生成Ti,电极反应式是TiO2 + 4e- = Ti + 2O2-;
(5)FeCl3溶液中三价铁离子水解使溶液显酸性,因此要选择酸性滴定管来进行滴定;三价铁离子能使KSCN溶液变为血红色,而反应后生成的二价铁离子则不能出现此现象,因此滴定终点时的现象是:溶液由无色变成红色且半分钟不褪色。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】如下图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是

A. 非金属性:![]()
B. 离子半径:![]()
C. ZM2分子中各原子的最外层均满足8电子稳定结构
D. 三种元素中,Y的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在101kPa,任何温度下,都不可能自发进行的反应是( )
A. N2 (g) + 3H2 (g)![]() 2NH3 (g) ΔH <0
2NH3 (g) ΔH <0
B. CaCO3(g)![]() CaO (s) + CO2 (g) ΔH >0
CaO (s) + CO2 (g) ΔH >0
C. 2CO (g)![]() 2C (s) + O2 (g) ΔH >0
2C (s) + O2 (g) ΔH >0
D. 4NH3 (g) + 5O2 (g)![]() 4NO (g) + 6H2O (g) ΔH <0
4NO (g) + 6H2O (g) ΔH <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出],t1时刻达到平衡,反应过程中混合气体的平均相对分子质量始终不变。请回答:

(1)写出该反应的化学方程式________________________________________;
(2)若t1=15 s,则用B的浓度变化表示的t0~t1阶段的平均反应速率为_____________;
(3)反应起始时B的体积分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用十分广泛。
(1)二价钴离子的核外电子排布式为______。基态Co原子核外3d能级上有______个未成对电子。Co与Ca属同周期,且核外最外层电子构型相同,但金属钴熔沸点都比钙高,原因是______。
(2)0.1mol[Co(NO2)6]3-中所含的σ键数目是______,K3[Co(NO2)6]中K、N、O三种元素的第一电离能由大到小的顺序是______。
(3)化合物四氨基钴酞菁分子的结构式如图。四氨基钴酞菁中N原子的杂化轨道类型为______。
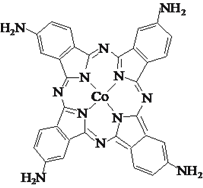
(4)[Co(NH3)6]Cl3晶体可由CoCl2溶于氨水并通入空气制得,该配合物中配体分子的立体构型是______。
(5)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个,该钴的化合物的化学式是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
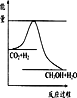
(1)关于该反应的下列说法中,正确的是_______;
A.△H>0,△S>0; B.△H>0,△S<0; C.△H<0,△S<0; D.△H<0,△S>0。
(2)该图中能量的最高点和最低点之间的差值代表___________;
(3)为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2) _________mol·L-1·min-1。
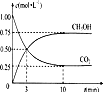
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是
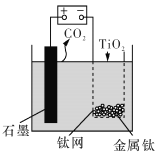
A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.下列说法中不正确的是
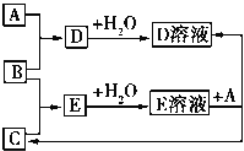
A. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B. A、B、C中三种元素形成的化合物所属物质类别一定不是碱
C. 如果E溶液是一种强酸,则E溶液为盐酸
D. A、B、C中有一种金属且为A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示。

容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是
A. 由图可知T1<T2,且该反应为吸热反应
B. 前10min内甲、乙、丙三个容器中反应的平均速率:v(A)乙<v(A)甲< v(A)丙
C. 平衡时A的转化率a:a乙<a甲<a丙
D. T1时该反应的平衡常数K=7.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com