
下列离子方程式,正确的是( )。
A.澄清石灰水中通入过量二氧化碳:Ca2++2OH- +CO2 ===CaCO3↓+H2O
B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2 +2OH- ===Na2 SiO3+H2O
D.硅酸与烧碱溶液中和:H2SiO3 +2OH- === SiO32-+2H2O
科目:高中化学 来源: 题型:
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
⑴制备氧化铜
工业CuSO4
 CuSO4溶液
CuSO4溶液 CuSO4·5H2O→……→CuO
CuSO4·5H2O→……→CuO
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是 。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
⑵探究氧化铜的性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则
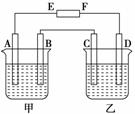
(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于硅单质及其化合物的说法正确的是( )。
 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素
 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品
 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维
 ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
 A.①② B.②③ C.①④ D.③④
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水中存在电离平衡:

 。下列叙述正确的是
。下列叙述正确的是
A.将水加热, 增大,
增大, 不变
不变
B.向水中加入少量NaHSO4固体,c(H+)增大, 不变
不变
C.向水中加入少量 固体,平衡逆向移动,
固体,平衡逆向移动, 降低
降低
D.向水中加入少量 固体,平衡正向移动,
固体,平衡正向移动, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL 18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量( )
A.小于0.45mo1 B.等于0.45mol
C.在0.45mol和0.9mol之间 D.大于0.9mo1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com