
| | | 氨碱法 | 联合制碱法 |
| A | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B | 可能的副产物 | 氯化钙 | 氯化铵 |
| C | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
 Na2CO3+CO2↑+H2O,放出的二氧化碳气体可回收循环使用。含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用,CaO+H2O=Ca(OH)2,2NH4Cl+ Ca(OH)2=CaCl2+2NH3↑+2H2O;联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体.由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品.此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用。联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱。A、氨碱法原料有:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气,联合制碱法原料有:食盐、氨气、二氧化碳,故A错误;B、氨碱法可能的副产物为氯化钙,联合制碱法可能的副产物氯化铵,故B正确;C、氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠,二氧化碳,故C错误;D、氨碱法原料(食盐和石灰石)便宜,产品纯碱的纯度高,副产品氨和二氧化碳都可以回收循环使用,制造步骤简单,适合于大规模生产,但设备复杂;能耗高,氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,故D正确,答案选AC。
Na2CO3+CO2↑+H2O,放出的二氧化碳气体可回收循环使用。含有氯化铵的滤液与石灰乳[Ca(OH)2]混合加热,所放出的氨气可回收循环使用,CaO+H2O=Ca(OH)2,2NH4Cl+ Ca(OH)2=CaCl2+2NH3↑+2H2O;联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液。第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体.由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,而且氯化铵在氯化钠的浓溶液里的溶解度要比在水里的溶解度小得多,所以在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品.此时滤出氯化铵沉淀后所得的滤液,已基本上被氯化钠饱和,可回收循环使用。联合制碱法与氨碱法比较,其最大的优点是使食盐的利用率提高到96%以上,应用同量的食盐比氨碱法生产更多的纯碱。A、氨碱法原料有:食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气,联合制碱法原料有:食盐、氨气、二氧化碳,故A错误;B、氨碱法可能的副产物为氯化钙,联合制碱法可能的副产物氯化铵,故B正确;C、氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠,二氧化碳,故C错误;D、氨碱法原料(食盐和石灰石)便宜,产品纯碱的纯度高,副产品氨和二氧化碳都可以回收循环使用,制造步骤简单,适合于大规模生产,但设备复杂;能耗高,氨碱法的最大缺点还在于原料食盐的利用率只有72%~74%;联合制碱法最大的优点是使食盐的利用率提高到96%以上,废弃物少,故D正确,答案选AC。

 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源:不详 题型:单选题
| A.3 mol/L | B.2 mol/L | C.1.4 mol/L | D.1 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中c(CO32-):c(HCO3-)<1:2 |
| B.溶液中c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
| C.向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 |
| D.将混合液蒸干,水解加剧,最终得NaOH固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Na2O2 + 2N2O3→4NaNO2 + O2 | B.Na2O2 + 2NO2 →2NaNO2 + O2 |
| C.Na2O2 + N2O4→2NaNO3 | D.2Na2O2 + 2 Mn2O7 → 4NaMnO4 + O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
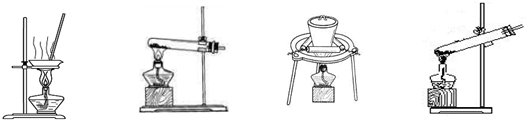
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论: 。 |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察 | 现象: ; 结论:样品中含有NaHCO3。 |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 | 现象: ; 结论: 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放在足量水中 |
| B.放在足量盐酸中 |
| C.放在足量CuSO4溶液中 |
| D.用刺有小孔的铝,包好放入足量水底中(假设铝不参加反应) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②④ | C.③①④ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com