
铜粉放入稀硫酸溶液中,加热后无明显现象发生,当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是
A.KNO3 B.NaCl C.Na2CO3 D.FeSO4
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:填空题
由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。化合物有E最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯.玉米淀粉等发酵制得,E的钙盐是人们喜爱的补钙剂之一。

已知: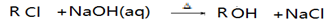
(1)D中所含官能团名称。E→G的反应类型为_________。
(2)聚合物F的结构简式。聚合物G的结构简式_________
(3)在一定条件下,两分子E在浓硫酸作用下形成一种六元环状化合物,该化合物的结构简式是_________。
(4)B转化为C的化学反应方程式是_________。
(5)下列四种化合物与E互为同分异构体的是_________。
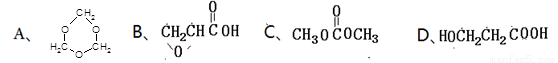
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:选择题
铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+且已知Ag+ +Fe2+=Ag+Fe3+,则下列推断正确的是
A.Tl+最外层有3个电子
B.氧化性:Tl3+>Ag+>Fe3+
C.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物
D.铊位于第五周期IIIA族
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:选择题
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
A.PH3分子中存在极性共价键
B.P—H键键长比N—H键键长长
C.PH3沸点低于NH3沸点,因为P-H键键能低
D.PH3分子稳定性低于NH3分子,因为N-H键键能高
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:填空题
最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有_____个电子层,最外层电子数为______,铯的原子序数为______。
(2)铯单质与水剧烈反应,放出____色气体,请写出反应的化学方程式:_________________。
(3)预测铯单质的还原性比钠单质的还原性________(填“弱”或“强”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列各组物质中化学键的类型相同的是
A.CaCl2 MgCl2 Na2O B.H2O Na2O CO2
C.CaCl2 NaOH H2SO4 D.NH4Cl H2O CO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
从下列实验事实得出的结论中,错误的是
选项 | 实验事实 | 结论 |
A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
C | 钠块投入水中,迅速熔成银白色小球 | 钠的密度比水小 |
D | 某溶液中加入浓NaOH溶液加热,产生使湿润红色石蕊试纸变蓝的气体 | 原溶液中含NH4+ |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉华中师大一附高一下期中化学试卷(解析版) 题型:选择题
下列离子方程式正确的有
A.向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:
Ca2++2ClO- +2H2O+2SO2= CaSO4↓+2Cl- +4H++SO42-
B.向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-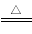 SO2↑+Cu2++2H2O
SO2↑+Cu2++2H2O
C.向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+ OH- H2O +CO32-
H2O +CO32-
D.用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH- NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三5月月考理综化学试卷(解析版) 题型:填空题
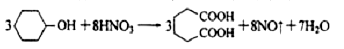
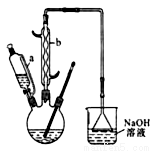
己二酸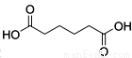 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
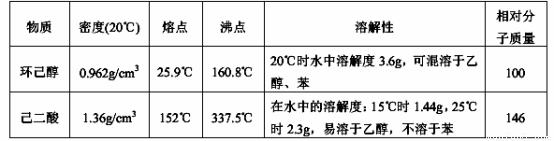
可能用到的有关数据如下:
实验步骤如下:
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1) 仪器b的名称为__________。
(2) 向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:____________________。
(3) 已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O 、NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:____________ _________、___________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com