
| A. | 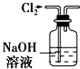 用如图所示装置除去Cl2中含有的少量HCl | |
| B. | 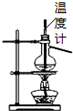 如图所示为石油分馏 | |
| C. | 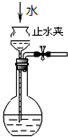 如图所示为检查装置气密性 | |
| D. | 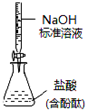 如图所示为测定未知盐酸的浓度 |
分析 A.氯气能与NaOH溶液反应;
B.分馏时测定蒸汽的温度;
C.根据能否产生压强差判断装置的气密性;
D.量取碱性溶液选择碱式滴定管.
解答 解:A.氯气能与NaOH溶液反应,所以除去Cl2中含有的少量HCl,应该把气体通入饱和食盐水中,故A错误;
B.分馏时测定蒸汽的温度,所以温度计的水银球应该在蒸馏烧瓶的支管口处,不能插入液体中,故B错误;
C.从长颈漏斗中加水,当水的液面高于长颈漏斗下端时,极性加水,漏斗中液面高于烧瓶中液面,而且液面差保持不变,则可以证明装置不漏气,故C正确;
D.量取碱性溶液选择碱式滴定管,所以NaOH标准溶液应该盛放在碱式滴定管中,故D错误.
故选C.
点评 本题考查化学实验方案的评价,涉及除杂质、蒸馏操作、气密性的检验等,把握实验原理及实验装置图的作用为解答的关键,注意方案的合理性、操作性分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
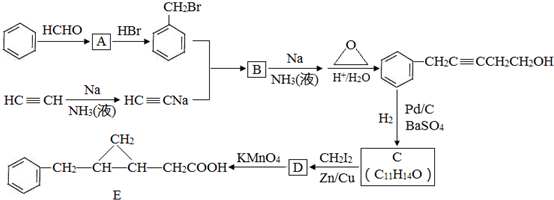
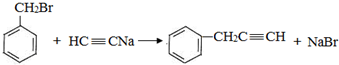 ,反应类型是取代反应.
,反应类型是取代反应.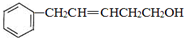 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个.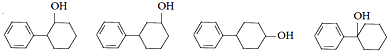 任意2种.
任意2种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
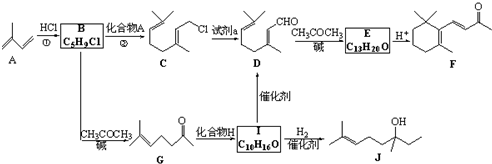
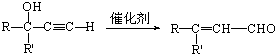 (R和R′表示烃基或氢)
(R和R′表示烃基或氢)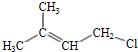 .
.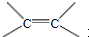 .
.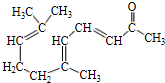 .
.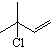 b.反应②的反应类型是加成反应
b.反应②的反应类型是加成反应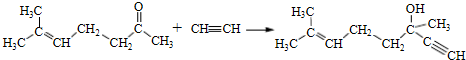 .
.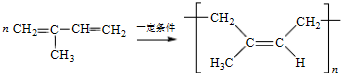 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
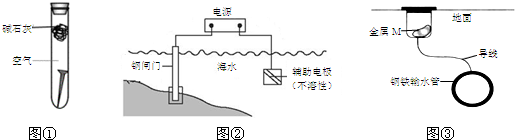
| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)=0.1 mol•L-1 | |
| B. | 0.2 mol•L-1NaHS溶液和0.1 mol•L-1Na2S溶液等体积混合,混合液中:3c(Na+)=4c(H2S)+4c(HS-)+4c(S2-) | |
| C. | KAl(SO4)2的水溶液中:c(SO42-)>c(A13+)>c(K+)>c(H+)>c(OH-) | |
| D. | H2SO3溶液中:c(H+)=2c(SO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
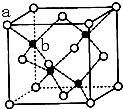 A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb
A、B、C、D、E、F为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{蒸发}{→}$AlCl3 | |
| B. | Cu$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{冷却结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{NaOH}{→}$Fe(OH)3$\stackrel{△}{→}$Fe2O3 | |
| D. | Mg$\stackrel{空气中燃烧}{→}$MgO$\stackrel{HCl}{→}$MgCl2溶液$\stackrel{蒸发}{→}$MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com