
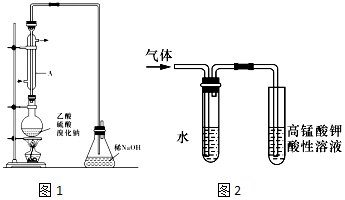
分析 I.(1)长玻璃导管的作用是冷凝回流;
(2)浓硫酸具有氧化性,可以将还原性的溴离子氧化为溴单质;
(3)溴单质溶解在有机物中显示棕黄色,溴单质可以和氢氧化钠发生反应;实现互不相溶液体的分离采用分液漏斗来分液;
(4)检验溴乙烷中含有溴元素一定要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验
II.(5)在加热条件下,溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯和HBr,HBr、乙醇极易溶于水,乙烯不易溶于水,乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:I.(1)实验时,长玻璃导管的作用是冷凝回流,可以获得要制取的有机物,
故答案为:冷凝回流;
(2)浓硫酸具有氧化性,可以将还原性的溴离子氧化为溴单质,得到的红棕色气体为溴蒸气,浓硫酸自身被还原为二氧化硫,
故答案为:Br2;
(3)溴单质溶解在有机物中显示棕黄色,为了除去粗产品中的杂质溴单质,溴在乙醇中溶解度不大,故不选;CCl4能溶解溴乙烷和溴,故不选,可以用氢氧化钠来与之发生反应生成的溶液和溴乙烷互不相溶,实现溴乙烷和氯化钠、次氯酸钠水溶液的分离可以采用分液法,用分液漏斗来分液,
故答案为:a;分液漏斗;
(4)溴乙烷为非电解质,不能电离出Br-,检验溴乙烷中含有溴元素一定要将之转化为溴离子,可以采用卤代烃的水解方法,即加入氢氧化钠即可,在溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀溴化银来检验,可以加入硝酸酸化的硝酸银,所以实验的操作顺序为④①③②,
故答案为:溴乙烷为非电解质,不能电离出Br-,不能与硝酸银溶液反应生成沉淀;④①③②;
(5)在加热条件下,溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯和HBr,HBr、乙醇极易溶于水,乙醇和HBr都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙烯不易溶于水,乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以看到的现象是:右边试管中酸性高锰酸钾溶液褪色,左边试管中水的作用是除去乙醇等杂质的干扰,
故答案为:酸性高锰酸钾溶液褪色;除去乙醇等杂质干扰.
点评 本题考查物质制备实验,为高频考点,考查学生实验分析的能力,明确实验原理及基本操作步骤是解本题关键,知道卤代烃中卤元素检验方法及实验现象,易错点是(5)中乙醇能被酸性高锰酸钾溶液氧化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内各物质X、Y、Z的浓度之比为1:1:2 | |
| D. | 单位时间内消耗0.1 molX,同时生成0.2 molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含 I- | B. | 肯定不含 SO42- | C. | 可能含有 SO32- | D. | 肯定含有 NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,用秸秆可制得葡萄糖和酒精 | |
| B. | 铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁的稳定 | |
| C. | 氧气被用作火箭的燃料,利用了氧气的可燃性 | |
| D. | 稀有气体充入霓虹灯,利用了稀有气体通电时发出不同颜色的光的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验A | 实验B | |
| 操作 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL饱和NaHCO3溶液. | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL蒸馏水. |
| 现象 | 有气体产生,20min后注射器内壁和底部产生大量白色沉淀 | 缓慢产生气体 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com