
 .
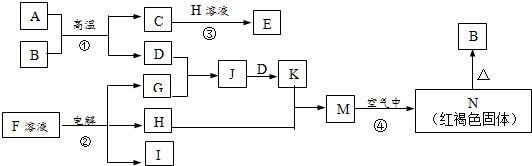
.分析 反应①常被应用于野外焊接钢轨判断为铝热反应,A和B为Al和铁的氧化物,依据转化关系CD为铁和氧化铝,F是海水中含有盐的主要成分,结合转化关系反应条件推断为NaCl,J为D、G反应产物形成的水溶液,可以继续和D反应生成K,K+H=M,M为Fe(OH)2,推断H为NaOH,G为Cl2,D为Fe,J为FeCL3,K为FeCl2,N为Fe(OH)3,N加热反应生成B为Fe2O3,推断铝热反应中A为Al,B为Fe2O3,C为Al2O3,E为NaAlO2;
综上所述各物质为:A为Al,B为Fe2O3,C为Al2O3,D为Fe,E为NaAlO2,F为NaCl,G为Cl2,H为NaOH,J为FeCL3,K为FeCl2,I为H2,M为Fe(OH)2,N为Fe(OH)3,据此进行解答.
解答 解:反应①常被应用于野外焊接钢轨判断为铝热反应,A和B为Al和铁的氧化物,依据转化关系CD为铁和氧化铝,F是海水中含有盐的主要成分,结合转化关系反应条件推断为NaCl,J为D、G反应产物形成的水溶液,可以继续和D反应生成K,K+H=M,M为Fe(OH)2,推断H为NaOH,G为Cl2,D为Fe,J为FeCL3,K为FeCl2,N为Fe(OH)3,N加热反应生成B为Fe2O3,推断铝热反应中A为Al,B为Fe2O3,C为Al2O3,E为NaAlO2;
根据分析可知:A为Al,B为Fe2O3,C为Al2O3,D为Fe,E为NaAlO2,F为NaCl,G为Cl2,H为NaOH,J为FeCL3,K为FeCl2,I为H2,M为Fe(OH)2,N为Fe(OH)3,
(1)B为氧化铁,化学式为Fe2O3,
故答案为:Fe2O3;
(2)H为氢氧化钠,氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合而成,NaOH的电子式: ,
,
故答案为: ;
;
(3)反应②是电解饱和食盐水,反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2Na++OH-+H2↑+Cl2↑;
(4)反应③为Al2O3和NaOH的反应,反应的化学方程式为:Al2O3+NaOH=2NaAlO2+H2O,
故答案为:Al2O3+NaOH=2NaAlO2+H2O.
点评 本题考查无机物的推断,题目难度中等,反应①的用途及M到N的现象等是推断突破口,需要学生熟练掌握元素化合物知识,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ②③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:X<Y<W | B. | 简单氢化物的热稳定性:Y>Z | ||
| C. | 简单离子的半径:W>Y>Z | D. | 四种元素只能形成两种离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理相同 | |
| C. | 为了防止中秋月饼等富脂食品氧化变质,延长保质期,可在包装袋中放入生石灰 | |
| D. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ AlO2- | B. | Na+ SO42- | C. | Cu2+ SO42- | D. | Na+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Cl-、Na+、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Na+、K+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+H2O(g)?CO(g)+H2(g) 加入大量C固体,V正 增大,V逆 减小 | |
| B. | Zn(s)+HCl(aq)═ZnCl2(aq)+H2(g),使用纯锌比粗锌反应速率快 | |
| C. | 对于反应H2(g)+I2(g)?2HI(g),恒温恒容充入Ne,容器内压强增大,V正、V逆 均增大 | |
| D. | 对于反应2SO2(g)+O2(g)═2SO3(g)当升高温度V正、V逆 都加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅溶于水所得溶液能使紫色石蕊溶液变为红色 | |
| B. | 二氧化硅是非金属化物,易溶于水 | |
| C. | 二氧化硅与石棉(CaO•3MgO•4SiO2)都是硅盐酸 | |
| D. | 二氧化硅与硅酸都能溶于烧碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com