
【题目】【2014年高考江苏卷第20题】硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-S (n—1)S+ S2- Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
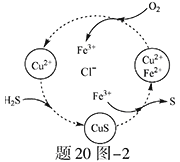
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如题20图—2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
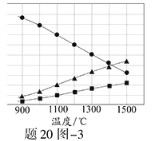
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图—3所示,H2S在高温下分解反应的化学方程式为 。

【答案】 (1)① 2H2O+2e-=H2↑+2OH-
② Sn2-+2H+=(n-1)S↓+ H2 S↑
(2)①Cu、Cl ②0.5mol ③提高空气的比例(增加氧气的通入量)
(3)2H2S![]() 2H2+S2
2H2+S2
【解析】本题的解题要点为电解电极反应式书写、氧化还原反应中电子的转移计算、平衡中
反应物转化率提高措施及有关特定条件下方程式书写等内容,做题时要关注试题给出的隐含
信息和图像信息,把握关键找到突破点。
(1)阴极是水产生的氢离子放电;电解后生成Sn2-,与酸发生歧化反应反应生成硫单质和硫化氢;(2)根据电子守恒,硫化氢电子给了氧气,氧气得电子为0.5mol;增加铁离子含量,使硫化铜被充分氧化,所以需增加氧气使亚铁离子被充分氧化;(3)由图判断生成两种气体体积比为2:1,只能产生S2才符合题意。
【命题意图】本题考查化学反应原理中电解电极反应式书写、氧化还原反应中电子的转移计算、平衡中反应物转化率提高措施及有关特定条件下方程式书写等内容,考察学生对电化学、氧化还原反应原理、特定条件下方程式书写等知识和学生的知识的应用迁移能力,考察了应用所学知识进行必要的分析、类推或计算一些具体的化学问题的能力和创新思维。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Zn还原SiCl4的反应如下:
SiCl4(g)+2Zn(l)![]() Si(s)+2ZnCl2(g)ΔH1
Si(s)+2ZnCl2(g)ΔH1
SiCl4(g)+2Zn(g)![]() Si(s)+2ZnCl2(g)ΔH2
Si(s)+2ZnCl2(g)ΔH2
下列说法正确的是
A.Zn(l)=Zn(g)ΔH=1/2(ΔH1-ΔH2)
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,ΔH2变大
D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
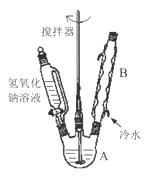
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
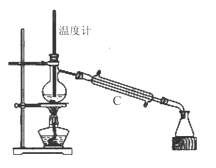
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是( )
A.1×10-7mol·L-1 B.1×10-12mol·L-1
C.1×10-2mol·L-1 D.1×10-14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
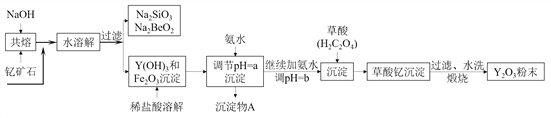
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.7 | 3.7 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
①最好选用盐酸和__________两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式__________。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在__________范围内;继续加氨水调节pH=b发生反应的离子方程式为__________;检验Fe3+是否沉淀完全的操作方法是__________。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 煤经过气化、液化等物理变化可转变为清洁燃料
B. 棉、麻、丝、有机玻璃都是天然高分子材料
C. 颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
D. 青铜、黄铜、碳素钢都属于合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A .分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C .分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物分子中,所有的碳原子可能不处于同一平面上的是
A. CH2=CH-CH3
B. C6H5-CH=CH2
C. C6H5-CH3
D. CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光纤通信是70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光导纤维是由下列哪种物质经特殊工艺制成的
A.石墨 B.石英 C.石灰石 D.高纯硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com