
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | C. | BCl3、NH3、CO2 | D. | SO3、BF3、H3O+ |
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对对数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,
A.中心原子都是sp3杂化,其键角相同;
B.中心原子都是sp3杂化,但孤电子对数不同,分子的键角不相同;
C.BCl3是sp2杂化,NH3为sp3杂化,CO2为sp杂化,分子的键角不相同;
D.SO3和BF3的中心原子为sp2杂化,而H3O+为sp3杂化,分子的键角不相同.
解答 解:A.CCl4中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,SiCl4中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,SiH4中C原子杂化轨道数=σ键数+孤对电子对数=4+0=4,所以采取sp3杂化,中心原子都是sp3杂化,其键角相同,故A错误;
B.H2S中S原子杂化轨道数=σ键数+孤对电子对数=2+$\frac{6-2}{2}$=4,所以采取sp3杂化,分子构型为V型,NF3中氮原子杂化轨道数=σ键数+孤对电子对数=3+$\frac{5-3}{2}$=4,所以采取sp3杂化,分子构型为四面体型,CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,分子构型为正四面体型,中心原子都是sp3杂化,孤电子对数不同,分子的键角不相同,故B正确;
C.BCl3中B原子杂化轨道数=σ键数+孤对电子对数=3+0=3,sp2杂化,分子的立体构型为平面三角形,NH3中氮原子杂化轨道数=σ键数+孤对电子对数=3+$\frac{5-3}{2}$=4,所以采取sp3杂化,CO2中碳原子杂化轨道数=δ键数+孤对电子对数=2+0=2,所以采取sp杂化,BCl3、NH3、CO2中心原子杂化类型不相同,分子或离子的键角不相等,故C错误;
D.SO3中,价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,含孤电子对数为0,杂化轨道数3,硫原子采用sp2杂化,分子形状为平面三角形;BF3中B原子杂化轨道数=σ键数+孤对电子对数=3+0=3,sp2杂化,分子的立体构型为平面三角形,H3O+中O原子杂化轨道数=σ键数+孤对电子对数=3+$\frac{6-3-1}{2}$=4,所以采取sp3杂化,分子构型为三角锥型,SO3、BF3、H3O+中心原子杂化类型不相同,分子或离子的键角不相等,故D错误;
故选B.
点评 本题主要考查了原子的杂化、分子的空间构型等知识,为高频考点,注意孤电子对的确定以及原子杂化理论的应用为解答关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100mL).| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
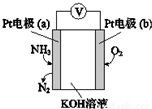
| A. | 该传感器在工作过程中KOH的物质的量不变 | |
| B. | a极的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | b极为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com