
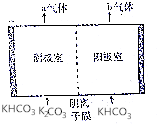
 为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )
为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )| A. | 阴极室产生的a气体是H2 | B. | 阳极室产生的b气体是CO2 | ||
| C. | 阴离子从阴极室向阳极室迁移 | D. | 再生液(K2CO3)在阴极室产生 |
分析 阴极发生还原反应,2H2O+2e-═H2↑+2OH-,OH-与HCO3-反应得到CO32-,再生碳酸钾溶液,阳极发生氧化反应,OH-在阳极失电子:2H2O-4e-═O2↑+4H+,产生的H+消耗溶液中的HCO3-:H++HCO3-═CO2↑+H2O,在阴极室中的HCO3-、CO32-进入阳极室,发生反应CO32-+CO2+H2O═2HCO3-或CO32-+H+═HCO3-,使HCO3-得以补充,使阳极溶液组成和浓度基本不变.
解答 解:阴极发生还原反应,2H2O+2e-═H2↑+2OH-,OH-与HCO3-反应得到CO32-,阴极室产生的a气体是H2,再生液(K2CO3)在阴极室产生;
阳极发生氧化反应,OH-在阳极失电子:2H2O-4e-═O2↑+4H+,产生的H+消耗溶液中的HCO3-:H++HCO3-═CO2↑+H2O,在阴极室中的HCO3-、CO32-进入阳极室,发生反应CO32-+CO2+H2O═2HCO3-或CO32-+H+═HCO3-,使HCO3-得以补充,使阳极溶液组成和浓度基本不变,阳极室产生的b气体是O2、CO2,
故选:B.
点评 本题考查电解原理应用,侧重考查学生运用知识分析解决问题的能力,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4、C3H4 | B. | C2H4、C3H8、C2H6 | C. | C2H2、C2H4、C3H6 | D. | C2H2、C2H6、C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| B. | 蛋白质、棉花、聚氯乙烯、淀粉都是自然界存在的天然高分子化合物 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界,这一完美结合现实与理论的化学系统模型,为全面了解并预测化学反应进程奠定了基础 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低极易被引燃,加热时最好用水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
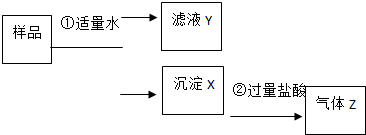 某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行 | |
| C. | 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com