
| 1000ρω |
| M |
| m |
| M |
| 1000ρω |
| M |
| 1000×1.17×36.5% |
| 36.5 |
| 0.05L×11.7mol/L |
| 0.2L |
| 13g |
| 65g/mol |
| 0.2mol×2 |
| 2 |


科目:高中化学 来源: 题型:

| A、可以在催化剂作用下和溴反应 |
| B、可以在碱性条件下发生水解反应 |
| C、能够使酸性高锰酸钾溶液褪色 |
| D、可以和浓硫酸与浓硝酸的混合液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
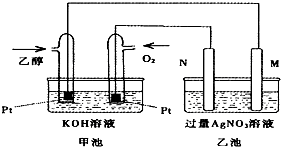 如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )
如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )| A、M电极的材料是石墨 |
| B、若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C、在此过程中,甲池中OH-向通乙醇的一极移动 |
| D、在此过程中,乙池溶液中电子从M电极向N电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、电解MgCl2溶液,可制得金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、变质的油脂有难闻的气味,是由于油脂发生了水解反应 |
| B、为了防止食品受潮及氧化变质,常在包装袋中加入无水硫酸铜和还原铁粉 |
| C、使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| D、在流感多发场所可使用乙醇、过氧化氢、次氯酸钠等消毒液进行消毒,消毒液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、HCl、Na2S |
| B、Na2O2、CH4、SiH4 |
| C、CS2、CCl4、N2 |
| D、HCl、H2O、NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com