
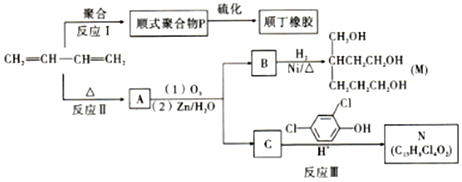
 +
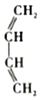
+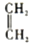 $\stackrel{△}{→}$
$\stackrel{△}{→}$
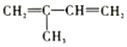 的名称是2-甲基-1,3-丁二烯.
的名称是2-甲基-1,3-丁二烯. b.
b. c.
c.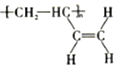
 ;反应III的化学方程式是
;反应III的化学方程式是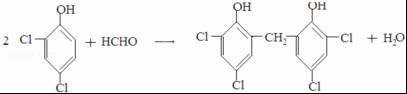 ;1molB完全转化成M所消耗H2的质量是6g.
;1molB完全转化成M所消耗H2的质量是6g.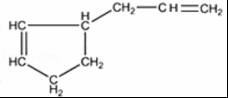 .
.分析 根据转化关系知,1,3-丁二烯发生聚合反应I得到顺式聚合物P为聚顺1,3-丁二烯,则P的结构简式为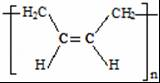 ,由信息i知,在加热条件下发生反应II生成A,A的结构简式为
,由信息i知,在加热条件下发生反应II生成A,A的结构简式为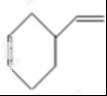 ,A发生反应生成B和C,B和氢气发生加成反应生成M,则B的结构简式为
,A发生反应生成B和C,B和氢气发生加成反应生成M,则B的结构简式为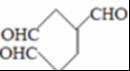 ,C和二氯苯酚发生反应生成N,C为醛,根据N中碳原子个数知,一个C分子和两个二氯苯酚分子发生反应生成N,N的结构简式为
,C和二氯苯酚发生反应生成N,C为醛,根据N中碳原子个数知,一个C分子和两个二氯苯酚分子发生反应生成N,N的结构简式为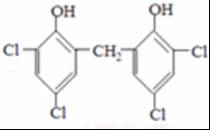 ,则C的结构简式为HCHO,以此解答该题.
,则C的结构简式为HCHO,以此解答该题.
解答 解:(1)由结构简式可知名称是2-甲基-1,3-丁二烯,故答案为:2-甲基-1,3-丁二烯;
(2)通过以上分析知,反应Ⅰ的反应类型是加聚反应,故答案为:a;
(3)通过以上分析知,顺式聚合物P的结构式是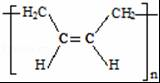 ,故答案为:b;
,故答案为:b;
(4)A的相对分子质量为108,1,3-丁二烯的相对分子质量是54,则A的结构简式为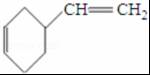 ,则
,则
反应Ⅱ的化学方程式是2CH2=CH-CH=CH2$\stackrel{△}{→}$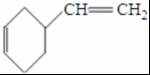 ,C是甲醛,甲醛和二氯苯酚反应生成N,所以反应Ⅲ是C和二氯苯酚反应生成的化学方程式是
,C是甲醛,甲醛和二氯苯酚反应生成N,所以反应Ⅲ是C和二氯苯酚反应生成的化学方程式是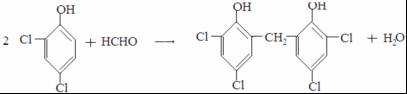 ,B的结构简式为
,B的结构简式为 ,含有3个醛基,1molB可与3mol氢气发生加成反应,则1molB完全转化成M所消耗H2的质量是6g,
,含有3个醛基,1molB可与3mol氢气发生加成反应,则1molB完全转化成M所消耗H2的质量是6g,
故答案为:2CH2=CH-CH=CH2$\stackrel{△}{→}$ ;
; ;6;
;6;
(5)根据以上分析知,B是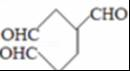 、C是HCHO,A的某些同分异构体在相同的反应条件下也能生成B和C,符合条件A的同分异构体有
、C是HCHO,A的某些同分异构体在相同的反应条件下也能生成B和C,符合条件A的同分异构体有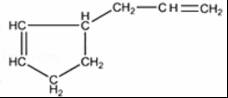 ,
,
故答案为: ;
;
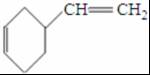
(6)以CH2=CH-CH=CH2和CH2=CH2为原料,合成己二酸,可先生成环己烯,氧化生成己二醛,氧化生成己二酸,流程为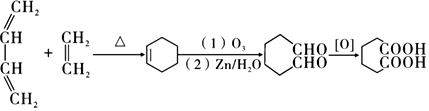 ,
,
故答案为: .
.
点评 本题考查了有机物的推断,为高考常见题型,侧重于学生的分析能力的考查,根据1,3-丁二烯为突破口结合题给信息、M和N的结构简式确定发生的反应,注意理解题给信息中有机物的断键和成键物质,难点是同分异构体结构简式的判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
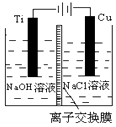 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能 | |
| B. | 化学反应不一定都有能量变化 | |
| C. | 活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响 | |
| D. | 活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者H+浓度可能均为0.01 mol/L | |
| B. | 两者的浓度均为0.01 mol/L | |
| C. | 醋酸中H+浓度一定大于盐酸中H+浓度 | |
| D. | 盐酸浓度一定大于醋酸浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和丁烷都存在同分异构体 | |
| B. | (CH3CH2)2CHCH3的系统命名是2-乙基丁烷 | |
| C. | 氧气和臭氧互为同素异形体 | |
| D. | 甲烷与异戊烷互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
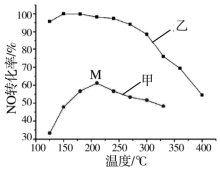 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
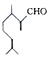 )是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯(
)是一种重要的香料,在硫酸的作用下能生成对异丙基甲苯( 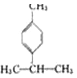 ).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )
).下列有关香叶醛与对异丙基甲苯的叙述正确的是( )| A. | 两者互为同分异构体 | |
| B. | 两者均能与溴水反应加成反应 | |
| C. | 香叶醛的一种同分异构体可能是芳香醇 | |
| D. | 对异丙基甲苯的分子式为C10H14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com