
已知:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,
2NaOH+Cl2↑+H2↑,![]() 、
、![]() ,又知丁苯橡胶的结构简式为:
,又知丁苯橡胶的结构简式为:

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
 (2009?广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(2009?广州模拟)氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
| ||
| ||
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
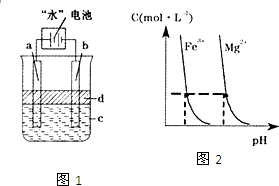 “水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有
“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com