
| A、所得混合液中c (Na+)>c (CH3COO-)>c (H+)>c (OH-) |
| B、混合后溶液pH=7 |
| C、混合后溶液中存在c (CH3COOH )+c (CH3COO-)=c (Na+)+c (H+) |
| D、所得混合液中存在c (CH3COOH )+c (CH3COO-)=0.05mol/L |
| 0.1mol/L×V |
| 2V |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、肯定没有KNO3 |
| B、肯定没有Ba(NO3)2和KNO3 |
| C、肯定没有Ba(NO3)2,可能有Na2CO3 |
| D、肯定没有Ba(NO3)2,可能有KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
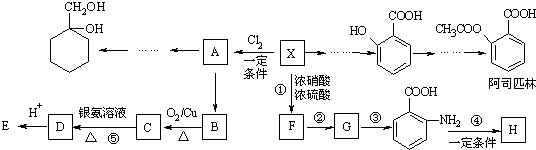
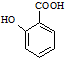
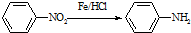 (苯胺,易被氧化)
(苯胺,易被氧化)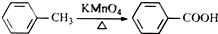
 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有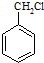 和其他无机物合成
和其他无机物合成 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物中Cu的物质的量为0.2 mol |
| B、产生的NO在标准状况下的体积为4.48L |
| C、硝酸的物质的量浓度为2.6mol/L |
| D、Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1的硫化钾溶液中:c(OH-)>c(HS-)+2c(H2S) |
| B、常温下,pH=7的CH3COOH与CH3COONa的混合液中:c(CHC3OO-)<c(Na+) |
| C、0.1mol?L-1的NH4Cl溶液中:c(NH4+)>c(H+)>c(Cl-)>c(OH-) |
| D、pH=3的一元酸和pH=11的一元强碱等体积混合:c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
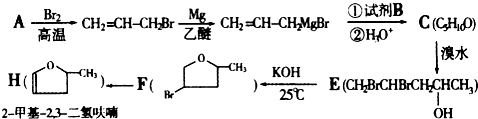
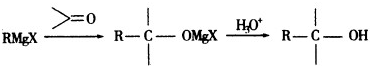
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com