
分析 n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,根据转移电子相等计算生成氢气质量,根据Zn原子守恒计算n(ZnCl2),再根据m=nM计算氯化锌质量.
解答 解:n(Zn)=$\frac{6.5g}{65g/mol}$=0.1mol,根据转移电子相等得m(H2)=$\frac{0.1mol×2}{2}×2g/mol$=0.2g;
根据Zn原子守恒得n(ZnCl2)=n(Zn)=0.1mol,则m(ZnCl2)=0.1mol×136g/mol=13.6g,
答:制得氢气、氯化锌的质量分别是0.2g、13.6g.
点评 本题考查化学方程式的计算,为高频考点,明确各个物理量关系是解本题关键,注意原子守恒、转移电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
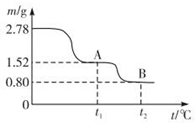 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
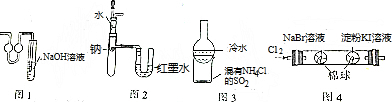
| A. | 图1装置用于二氧化硫尾气的吸收 | |
| B. | 图2装置用于验证Na和水反应的热效应 | |
| C. | 加热图3装置中的烧杯,分离SiO2和NH4Cl | |
| D. | 图4装置用于证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:选择题
下列设计的实验方案能达到实验目的是
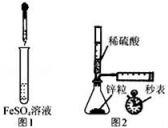
A.制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B.测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C.除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤
D.检验淀粉是否水【解析】
取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:填空题
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为______________,A电极的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“ 基本不变”)。
基本不变”)。
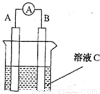
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流 ,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为___________;正极反应为_______________________。
(3)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32-4e-=4CO2,正极反应式为________________________,电池总反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
在某澄清、透明的浅黄色溶液中,可能含有:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-八种离子中的几种,在检验方案设计时初步分析其溶液中最多可含的离子(不包括OH-)有( )
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
| A. | N溶液与过量的F溶液反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E溶液与N溶液混合发生反应的离子方程式为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| C. | M溶液与F溶液混合产生的沉淀不能溶解于过量氨水中 | |
| D. | 将G溶液逐滴加入等体积、等物质的量的浓度的E溶液中,反应的离子方程式为2H++CO32-═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com