
【题目】某化学小组做完高温下铁与水蒸气反应的实验后得到一种黑色粉末。他们为探究该黑色粉末中是否有未反应完的铁粉,又进行了如下实验,装置如图1所示。请回答下列问题:
(1)铁与水蒸气反应的化学方程式是_____________________;
(2)按图1连接好仪器后,检查装置的气密性的操作方法是_______________;
(3)仪器b的名称是_____,往仪器b中加入的试剂可能是______(填一种);
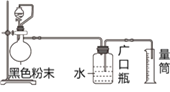
(4)实验中观察到烧瓶中有气泡产生,则黑色粉末中_______(填“有”或“无”)铁粉,产生气泡的离子方程式是________________________;
(5)如果黑色粉末的质量为w g,当时实验条件下产生的气体的密度为ρg/cm3 ,多次试验求出量筒中液体平均体积为a mL,则黑色粉末中铁的氧化物的质量分数为__________________。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好 分液漏斗(或恒压分液漏斗) 盐酸或稀硫酸 有 Fe+2H+=Fe2++H2↑ (w-28aρ)/w
Fe3O4+4H2 将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好 分液漏斗(或恒压分液漏斗) 盐酸或稀硫酸 有 Fe+2H+=Fe2++H2↑ (w-28aρ)/w
【解析】
(1)铁与水蒸气反应的化学方程式是:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)检查装置的气密性的操作方法是将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好。
(3)仪器b的名称是分液漏斗(或恒压分液漏斗),往仪器b中加入的试剂可能是盐酸或稀硫酸,因为铁和盐酸或稀硫酸反应生成氢气。
(4)Fe+2H+=Fe2++H2↑。
(5)氢气的密度为ρg/cm3,体积为a mL,质量为ρag,
Fe+2H+=Fe2++H2↑
56 2
x ρag
x=28ρag。
(1)高温下铁与水蒸气反应的实验后得到一种黑色粉末,是四氧化三铁,故铁与水蒸气反应的化学方程式是:3Fe+4H2O(g)![]() Fe3O4+4H2,故答案为:3Fe+4H2O(g)
Fe3O4+4H2,故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)按图1连接好仪器后,检查装置的气密性的操作方法是将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好,故答案为:将导管末端放入水槽中,微热烧瓶,如果水槽中产生气泡,停止加热后导管末端倒吸进一段水柱,证明装置气密性良好。
(3)仪器b的名称是分液漏斗(或恒压分液漏斗),往仪器b中加入的试剂可能是盐酸或稀硫酸,因为铁和盐酸或稀硫酸反应生成氢气,故答案为:分液漏斗(或恒压分液漏斗);盐酸或稀硫酸。
(4)实验中观察到烧瓶中有气泡产生,产生的气泡应该是氢气,则黑色粉末中有铁粉, 离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:有;Fe+2H+=Fe2++H2↑。
(5)氢气的密度为ρg/cm3,体积为a mL,质量为ρag,
Fe+2H+=Fe2++H2↑
56 2
x ρag
x=28ρag
所以铁的氧化物的质量为:w g-28ρag,质量分数为:(w-28aρ)/w×100%,
故答案为:(w-28aρ)/w。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2.6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

请回答:
(1)常温下,氯化锶溶液pH___ 7(填“大于”、“等于”或“小于”);
(2)写出步骤②在浆液中加入盐酸时发生反应的离子方程式 ___;
(3)步骤③所得滤渣的主要成分是____(填化学式),调节溶液pH至8~10,宜选用的试剂为 ___。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(4)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(5)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(6)若滤液中Ba2+浓度为1×10-6 mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为 ________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如右下图所示。

(1)基态Ti原子的价电子轨道表示式为 。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于 晶体,其电子式为 。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为 (标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的两种离子 (填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有 个;NaAlH4晶体的密度为 g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,v(O2)正=2v(SO3)逆
2SO3达到平衡时,v(O2)正=2v(SO3)逆
B. 用如图所示方法可保护钢闸门不被腐蚀

C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中![]() 的值增大
的值增大
D. 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是

容器 编号 | 温度/K | 起始物质的量/mol | |||
SO2 | NO | NO2 | S | ||
Ⅰ | 0.5 | 0.6 | 0 | 0 | |
Ⅱ | T1 | 0.5 | 1 | 0.5 | 1 |
Ⅲ | T2 | 0.5 | 0.2 | 1 | 1 |
A. 该反应的ΔH<0
B. T1时,该反应的平衡常数为![]()
C. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)乙烯和水反应:_________________________________________________
(2)乙醇的催化氧化反应:___________________________________________
(3)溴乙烷的消去反应:_____________________________________________
(4)![]() 与足量的NaOH溶液反应:__________________________________
与足量的NaOH溶液反应:__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶油中有一种只含C、H、O的化合物A 。A可用作香料,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
(1)A的分子式为___________,与A分子式相同的酯的同分异构体有_____________种。
已知:

又已知A中含有羰基和羟基两种官能团,在铜的催化下加热被氧气氧化的产物不能发生银镜反应:

(2)写出A → E、E → F的反应类型:A → E ___________、E → F ___________。
(3)写出C、F的结构简式:C ____________、F ___________。
(4)写出B → D反应的化学方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.4.1gH3PO3可与2gNaOH完全反应生成正盐,则H3PO3为__________元酸。该正盐的电离方程式为_________________。
Ⅱ、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.504gNaHCO3,2片小苏打片能中和胃酸中的H+是_____mol。
(2)胃舒平每片含0.234gAl(OH)3,中和胃酸时,6片小苏打片相当于胃舒平__________。
(3)达喜的化学成分是铝和镁的碱式碳酸盐。取该碱式盐粉末3.01g,逐滴加入2.0mol/L盐酸使其溶解(其他成分不与盐酸反应),当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时怡好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硫离子的结构示意图:![]()
B. 23Na、24Mg两种核素的中子数相等,因此互为同位素
C. CH3COOH的电离方程式为:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. 16O、1H、2H、3H四种核素可构成4种水分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com