
【题目】甲醇(CH3OH)是一种无色液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知:2CH3OH(g)+O2(g)2CO2(g)+4H2(g)的能量变化如图所示,下列说法正确的是_____。(填字母)

a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学反应不仅有新物质生成,同时也一定伴随能量变化
d.2mol甲醇和1mol氧气的总键能大于2mol二氧化碳和4mol氢气的总键能
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.4mol/L。则4min内平均反应速率v(H2)=_____,CH3OH的转化率为______。(转化率=某反应物转化浓度与该反应物起始浓度的百分比)
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。该燃料电池的总反应为CH3OH+O2+KOH=K2CO3+H2O(未配平)。回答下列问题:
①该电池的正极反应物为______。
②负极的电极反应式为_____。
【答案】c 0.6mol/(Lmin) 48% 氧气 CH3OH+8OH--6e-=CO32-+6H2O
【解析】
根据图示可知反应为放热反应,分析物质的总能量的大小和键能的大小。根据“三段式”计算出氢气的平均反应速率和转化率。根据燃料电池的原理进行判断。
(1) 根据化学反应:2CH3OH(g)+O2(g)2CO2(g)+4H2(g)
a.由图可知,反应物的能量高,生成物的能量低,CH3OH转变成H2的过程是一个放出能量的过程,故a错误;
b.H2的生成速率与CH3OH的消耗速率之比等于化学计量数之比,都为2∶1,故b错误;
c.化学反应不仅有新物质生成,有物质的变化,有化学键的断裂与形成,故一定伴随能量变化,故c正确;
d.反应放热中反应物的键能总和小于生成物的键能总和,因此,2mol甲醇和1mol氧气的总键能小于2mol二氧化碳和4mol氢气的总键能,故d错误;
答案选c;
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.4mol/L,列出三段式:

故v(H2)=![]() =0.6mol/(Lmin);
=0.6mol/(Lmin);
CH3OH的转化率=![]() ×100%=48%;
×100%=48%;
(3)CH3OH燃料电池中甲醇在负极失电子发生氧化反应,在碱性条件下生成碳酸根,电极反应为:CH3OH+8OH--6e-=CO32-+6H2O,氧气在正极得电子发生还原反应,电极反应为:O2+4e-+2H2O=4OH-。


科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
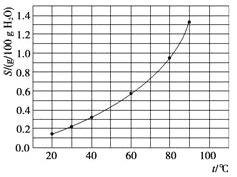
A. 溴酸银的溶解时放热过程
B. 温度升高时溴酸银溶解速度加快
C. 60 ℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为1.00L的密闭容器中通入一定量的N2O4和NO2的混合气体,发生反应:N2O4(g)![]() 2NO2(g)ΔH>0,体系中各物质浓度随时间变化如图所示。下列有关说法正确的是
2NO2(g)ΔH>0,体系中各物质浓度随时间变化如图所示。下列有关说法正确的是
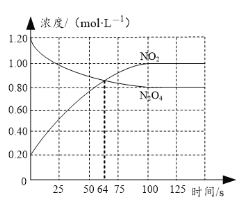
已知:NO2为红棕色气体,N2O4为无色气体
A.64s时,反应达到化学平衡状态
B.到达化学平衡前,混合气体的颜色逐渐变深
C.若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高
D.前100s内,用NO2浓度的变化表示的化学反应速率是0.008mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积不变的密闭容器中有可逆反应A(g)+ B(g) ![]() 2C(g)+D(s),可以判断反应达到平衡是( )
2C(g)+D(s),可以判断反应达到平衡是( )
A. 单位时间内反应nmol B同时生成2nmol C
B. 容器内气体的物质的量不再变化
C. A的生成速率与B的生成速率相等
D. 容器内气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和②B. ②和④C. ③和④D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚甲基蓝(Methylnene Blue)在碱性条件下与葡萄糖作用生成亚甲基白(Methylene White),亚甲基蓝的结构简式:
著名的蓝瓶子实验操作步骤如下:
①如图示在250mL锥形瓶中,依次加入2g NaOH、100mL H2O和3g葡萄糖,搅拌溶解后,再加入3滴~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;
②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;
③再打开瓶塞,振荡,溶液又变为蓝色;
④再塞紧橡皮塞,将溶液静置,溶液又变为无色,以上③、④可重复多次。
试回答下列问题:

(1)某学生将起初配得的蓝色溶液分装在A,B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色,若再同时振荡A,B试管,能显蓝色的是_________(填“A”或“B”);
(2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色_________(填“能”或“不能”);若塞紧锥形瓶塞并打开a、b通入足量氧气,溶液能否由无色变为蓝色_________(填“能”或“不能”);
(3)上述转化过程中,葡萄糖的作用是_________,亚甲基蓝的作用是_________;
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有_____;
(5)该实验中③、④操作能否无限次重复进行_________(填“能”或“不能”),理由是 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,可用作LED的基质材料,通过等离子法由SiH4(沸点-111.9℃)与氨气反应制取的方程式如下:3SiH4+4NH3=Si3N4+12H2。设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1.8gSiH4所含质子的数目为3.2NA
B.标准状况下,4.48LNH3和H2的混合气体所含分子总数为0.2NA
C.NA个NH3分子溶于1L的水,所得溶液的物质的量浓度为1mol·L-1
D.当生成1molSi3N4时,转移电子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为 800 ℃时A、B、C 三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
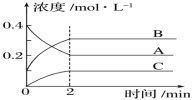
A.发生的反应可表示为 2A(g)2B(g)+C(g)
B.前 2 min A 的分解速率为 0.1 mol·L-1·s-1
C.2 min 时,A 的转化率为 50%
D.2 min 时,A、B、C 的浓度之比为 2:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、R的化合价与原子序数的关系如下图所示.下列说法不正确的是( )
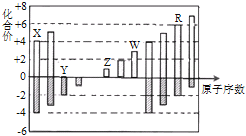
A. X、Y都存在同素异形现象
B. 工业上常用W的氧化物为原料制取单质W
C. Z和Y形成的化合物中只存在离子键
D. 常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com