
下列各表述与示意图一致的是


A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)
+ O2(g) 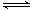 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B
【解析】
试题分析:根据图象中纵横坐标的含义,利用点、线来分析一个量发生变化随另外一个量如何变化,若变化趋势与图象中变化趋势一致,即为正确答案。A、0.1mol•L-1NaOH溶液的pH为13,用0.1mol•L-1盐酸滴定恰好中和时pH为7,由于浓度相同,则体积相同。但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;B、由于反应为放热反应,则升高温度,平衡逆向移动。所以平衡后升高温度K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;C、由于反应中生成的Mn2+对该反应能起催化剂的作用,从而使反应速率加快,因此与图像不符,C不正确;D、由于该反应是放热反应,所以反应物的总能量高于生成物的总能量,但图象描述的反应物的总能量低于生成物的总能量,因此D错误,答案选B。
考点:考查中和滴定、平衡常数、反应热等有关图像的分析与判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
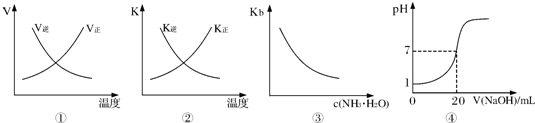
| A、图①表示反应N2(g)+O2(g)?2NO(g)△H>0正、逆反应的速率随温度的变化 | B、图②表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数随温度的变化 | C、图③表示氨水的电离平衡常数随氨水浓度c(NH3?H2O)的变化 | D、图④表示25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,溶液的pH随加入碱体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
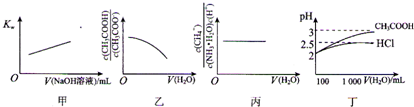
| A、图甲表示在纯水中加入0.01 moL?L-1 NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1 NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mL pH=2的HCl和CH3COOH加水稀释到1000mL时pH变化与水的体积的变化关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com