
下列关于有机物的说法正确的是
A.糖类、油脂、蛋白质一定都能发生水解反应
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.一定条件下,理论上1mol苯和1mol甲苯均能与3molH2反应
D.乙醇、乙酸均能与NaOH稀溶液反应,因为分子中均含有官能团“—OH ”
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
装置Ⅰ和装置Ⅱ、装置Ⅲ是有关硝酸和铜反应的实验装置示意图:
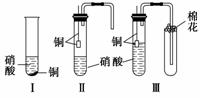
(1)若用装置Ⅰ进行铜与浓硝酸反应的实验,最大的缺点是____________________;
若用装置Ⅰ来证明铜与稀硝酸反应生成NO气体,其最大缺点是不能与浓硝酸跟铜反应形成鲜明对照。简述原因_____________________________________________________。
(2)若用装置Ⅱ进行适当操作,即可克服上述缺点,还能使上述两反应在同一试管中先后连续进行。实验步骤如下:
步骤一:组装好装置并______________后,加入2 mL浓硝酸(铜片接近酸液),塞紧胶塞。
步骤二:________________(操作)使反应发生。当导管口有少量红棕色气体逸出时,__________________________________________(操作)使反应停止。同时将导管插入水中。稍后能观察到:a.水沿导管倒吸至试管中;还可能观察到下列________(填序号)等明显现象;b.溶液由蓝色变为无色;c.铜片表面产生气泡;d.红棕色气体变为无色。请解释产生现象a的原因________________________________________________________________________
________________________________________________________________________。
步骤三:当试管中溶液体积约占试管容积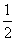 时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
步骤四:反应完毕后……
(3)上述实验“步骤四”中反应完毕后还需要进行的操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是 ( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
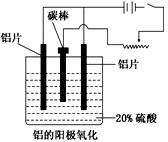 (1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的
方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,
可用电解方法进一步提纯,该电解池中阳极的电极
反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
工业常用燃料与水蒸气反应制备H2和CO, 再用H2和CO合成甲醇。
(1)制取H2和CO通常采用:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
CO(g)+H2(g) △H=+131.4 kJ·mol-1,下列判断正确的是 。
a.该反应的反应物总能量小于生成物总能量
b.标准状况下,上述反应生成1L H2气体时吸收131.4 kJ的热量
c.若CO(g)+H2(g) C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
C(s)+H2O(1) △H=-QkJ·mol-1,则Q<131.4
d.若C(s)+CO2(g) 2CO(g) △H1;CO(g)+H2O(g)
2CO(g) △H1;CO(g)+H2O(g) H2(g)+CO2(g) △H2 则:△H1+△H2=+131.4 kJ·mol-1
H2(g)+CO2(g) △H2 则:△H1+△H2=+131.4 kJ·mol-1
(2)甲烷与水蒸气反应也可以生成H2和CO,该反应为:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
已知在某温度下2L的密闭绝热容器中充入2.00mol甲烷和1.00mol水蒸气,测得的数据如下表:
| 不同时间各物质的物质的量/mol | ||||
| 0 min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |
根据表中数据计算:
①0 min ~ 2min 内H2的平均反应速率为 。
②达平衡时, CH4的转化率为 。在上述平衡体系中再充入2.00mol甲烷和1.00mol 水蒸气,达到新平衡时H2的体积分数与原平衡相比 (填“变大”、“变小”或“不变”),可判断该反应达到新平衡状态的标志有______。(填字母)
a.CO的含量保持不变 b.容器中c(CH4)与c(CO)相等
c.容器中混合气体的密度保持不变 d.3ν正(CH4)=ν逆(H2)
(3)合成甲醇工厂的酸性废水中含有甲醇(CH3OH),常用向废液中加入硫酸钴,再用微生物电池电解,电解时Co2+被氧化成Co3+,Co3+把水中的甲醇氧化成CO2,达到除去甲醇的目的。工作原理如下图( c为隔膜,甲醇不能通过,其它离子和水可以自由通过)。
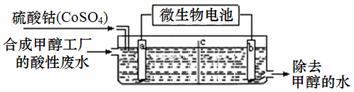
①a电极的名称为 。
②写出除去甲醇的离子方程式 。
③微生物电池是绿色酸性燃料电池,写出该电池正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用相同条件下的NH3 3L恰好反应完全,则混合气中NO与NO2的体积分数比
A.l:4 B.1:3 C .l:2 D.l:l
.l:2 D.l:l
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组设计了如下实验装置,欲探究铜和浓硝酸的反应是否有一氧化氮产生,如果有,什么浓度的硝酸就会产生NO(假设硝酸和铜的反应产物只可能产生NO或NO2 ,题中所涉气体体积均为标准状况下的数据,且忽略反应中溶液体积的变化)。

试回答下列问题:
(1)C装置中将铜粉分散在石棉绒中的原因是:______________________________;
B装置的作用为_______________________________________。
(2)在铜和浓硝酸反应前,挤压打气球鼓入空气,经A、B、C反应后,进人D中的气体主要是(填化学式),通入该气体的目的是______________________________;进行此步操作时应关闭,打开______(填k1,k2或k3)。
(3)关闭k1,k2,打开k3 ,由分液漏斗向装有一定量铜片的D中滴加14 mol/L浓硝酸10. 00 mL。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。你认为这么操作的目的是______________。
(4)若E中出现倒吸,可采取的应急操作是____________________________。
(5)从E装置所得溶液中取出25. 00 mL,加2-3滴酚酞试液,用0. 1000 mol/L的NaOH溶液滴定,当滴定达到终点时消耗NaOH溶液50. 00 mL;若实验结束后冷却到常温,准确测得F装置实验前后量气管的读数差值为386. 00 mL。从上述所得数据进行计算、分析,试判断_____________(“能”或“不能”)完成实验的探究目的;上述铜与浓硝酸反应中铜片____________(填‘过足”、“不足”或“恰好”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将5.1g镁铝合金,投入到500mL2.0mol/L的盐酸中,金属完全溶解,再加入4.0mol/L的NaOH溶液,若要生成的沉淀最多,则NaOH溶液的体积是: ( )
A.200mL B. 250ml C. 425mL D. 560mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com