
【题目】实验室里用如图所示仪器和药品来制取纯净的无水氯化铜(Cu+Cl2![]() CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。
CuCl2)。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长等部分未画出。根据要求填写下列各小题空白。

(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)(____)接(____)接(____)接(____)接(____)接(____),其中②与④装置相连时,玻璃管接口(用装置中字母表示)应是___接___。
(2)装置②的作用是___;装置④的作用是___。
(3)实验开始时,应首先检验装置的____,实验结束时,应先熄灭___处的酒精灯。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为____。
【答案】③ ⑤ ④ ② ① ⑥ C B 除去Cl2中的水蒸气 除去Cl2中的HCl气体 气密性 ① MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【解析】
利用实验室制得的氯气与铜反应制取纯净氯化铜,因实验室制得的氯气中混有氯化氯和水蒸气,需要除去后得到干燥的氯气再与铜在加热的情况下反应,为了得到纯净的氯化铜,在加热反应前需要将装置内的空气排出,形成无氧环境,同时要考虑氯气对环境有污染,需要用氢氧化钠溶液除去,据此分析解答。
(1)根据上述分析,仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后尾气处理;进行气体除杂或者干燥时,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用浓盐酸与二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,所以仪器连接顺序为:③⑤④②①⑥,其中②与④装置相连时,玻璃管接口应是C接B,故答案为:③⑤④②①⑥;C、B;
(2)装置②中盛装的是浓硫酸,可利用此装置干燥氯气,装置④中盛装的是饱和食盐水可以除去氯气中的氯化氢,故答案为:干燥氯气;除去氯气中混有的氯化氢;
(3)实验中涉及到气体,实验开始时一般都要检查装置的气密性,为了防止空气中的成分的干扰,实验结束时,有铜粉的装置中还应再通一会儿氯气至硬质玻璃管冷却,所以实验结束时,应先熄灭①处的酒精灯,故答案为:气密性;①;
(4)装置⑤是利用二氧化锰和浓盐酸混合加热制氯气,发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】长征三号甲运载火箭(CZ—3A)与“嫦娥工程“太空摆渡车”“北斗卫星”“风云卫星”等中国航天大事件紧密相连。它是大型三级液体推进剂火箭,一子级和二子级均使用偏二甲肼(UDMH)-四氧化二氮(NTO)推进剂,反应产物绿色无污染。回答下列问题:
(1)已知(CH3)2NNH2(l)+4O2(g)= 2CO2(g)+4H2O(g)+N2(g) △H=a kJ/mol
N2(g)+O2(g)= 2NO(g) △H=b kJ/mol
2NO(g)+O2(g)= N2O4(l) △H=c kJ/mol
则UDMH-NTO推进剂反应的热化学方程式为________________________。
(2)偏二甲肼易溶于水,其一水合物的电离方式与一水合氨(Kb=1.7×10-5)相似但电离常数更小,偏二甲肼一水合物的电离方程式为___________________,向偏二甲肼溶液中加入等物质的量的醋酸(Ka=-1.7×10-5),充分反应后溶液呈______(填“酸性”“碱性”或“中性”)。碱性偏二甲肼—空气燃料电池的电解质溶液是20~30%的KOH溶液,电池工作时正极的电极反应式为__________________________。
(3)N2O4是NO2的二聚产物,NO、NO2等氮氧化物是主要的大气污染物,氮氧化物与悬浮在大气中的微粒相互作用时,涉及如下反应:
(I)2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) △H1<0 K1
NaNO3(s)+ClNO(g) △H1<0 K1
(II)2NO(g)+Cl2(g)![]() 2ClNO(g) △H2<0 K2
2ClNO(g) △H2<0 K2
则4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+C12(g)的平衡常数为_______(用K1、K2表示);为研究不同条件对反应(Ⅱ)的影响,T℃时,向2L恒容密闭容器中加入0.2mol NO和0.2mol C12,5min时达到平衡,反应过程中容器内的压强减小了10%,则5min内反应的平均速率v(C1NO)=_____mol/(L·min),NO的平衡转化率α1=_____%;若其他条件保持不变,使反应(Ⅱ)在初始容积为2L的恒压密闭容器中进行,则NO的平衡转化率α2_______α1(填“>”“<”或“=”)。
2NaNO3(s)+2NO(g)+C12(g)的平衡常数为_______(用K1、K2表示);为研究不同条件对反应(Ⅱ)的影响,T℃时,向2L恒容密闭容器中加入0.2mol NO和0.2mol C12,5min时达到平衡,反应过程中容器内的压强减小了10%,则5min内反应的平均速率v(C1NO)=_____mol/(L·min),NO的平衡转化率α1=_____%;若其他条件保持不变,使反应(Ⅱ)在初始容积为2L的恒压密闭容器中进行,则NO的平衡转化率α2_______α1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1 mol/L的HClO2和,1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是 ( )
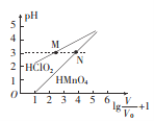
A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C. 在0≤pH≤5时,HMnO4溶液满足,pH= ![]()
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 1mol![]() Yb(镱)中含有的中子数为70NA
Yb(镱)中含有的中子数为70NA
B. 常温下,1LpH=13的Ba(OH)2溶液中由水电离的OH-数目为0.1NA
C. 在锌锰碱性电池中消耗13.0g负极材料,转移电子数为0.2NA
D. 常温常压下,28.0g丙烯和乙烯的混合气体中含有的氢原子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g) ===2H2O(l) ΔH=-571.66 kJ·mol-1
CO(g)+1/2O2(g) ===CO2(g) ΔH=-282.9 kJ·mol-1
若氢气与一氧化碳的混合气体完全燃烧可生成2.7 g H2O(l),并放出57.02 kJ热量,则混合气体中CO的物质的量约为( )
A. 0.22 mol B. 0.15 mol C. 0.1 mol D. 0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
(1)反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);滤渣Ⅰ成分是:__________。

(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。
Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为
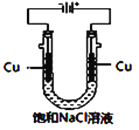
阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些不能支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法中正确的是
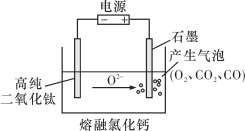
A. 阳极的电极反应式为2Cl--2e-===Cl2↑
B. 阴极的电极反应式为TiO2+4e-===Ti+2O2-
C. 通电后,O2-、Cl-均向阴极移动
D. 石墨电极的质量不发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com