
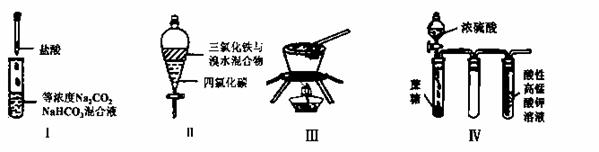
对于实验I〜IV的描述正确的是
A.实验I :逐滴滴加稀盐酸时,试管中立即产生大量气泡
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
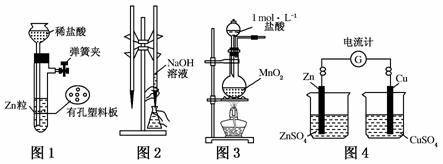
A.用图1所示装置制取少量H2
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸的浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置确定导线中有电流通过及电流方向
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点。观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
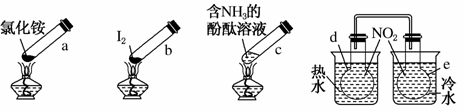
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳性比较好
B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体
C.加热时,c中溶液红色变深,冷却后又变浅
D.水浴时,d内气体颜色变浅,e内气体颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
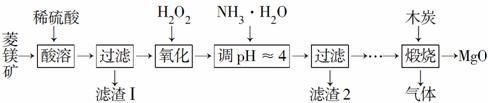
(1)MgCO3与稀硫酸反应的离子方程式为___________________ _____________________________________________________________________________________________________________________________。
(2)加入H2O2氧化时,发生反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)滤渣2的成分是____________________________________________ _________________________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C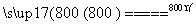 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C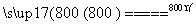 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C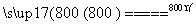 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。
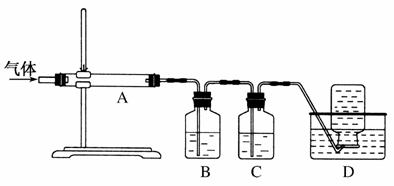
①D中收集的气体是________(填化学式)。
②B中盛放的溶液可以是________(填字母)。
a.NaOH溶液 b.Na2CO3溶液
c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体能与热的NaOH溶液反应,产物中元素的最高价态为+4,写出该反应的离子方程式:
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.实验室从海带提取单质碘的方法是:取样灼烧溶解 过滤萃取
B.用乙醇和浓制备乙烯时,可用水浴加热控制反应的温度
C.在室温下,向氯化银的沉淀溶解平衡的体系中加入蒸馏水,氯化银的Ksp保持不变
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制备Al2O3、K2FeO4和H2SO4的工艺流程如下: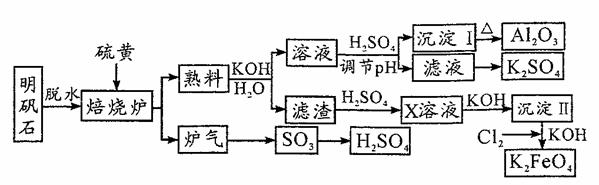
请回答下列问题:
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S =2Al2O3 +9SO2,该反应中氧化剂与还原剂的物质的量之比是 _ 。若生成102g Al2O3,转移的电子数目为 。
(2)写出化学式:沉淀Ⅰ是 ,沉淀Ⅱ是 ___________ 。
(3)熟料溶解时反应的离子方程式为______________________________________________。
(4)溶液经加硫酸调节pH后,过滤、洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 。
(5)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式:
______________________________________ 。
(6)“焙烧”过程中生成的SO2可用于制H2SO4。已知25℃,101kPa时:
2SO2(g) + O2(g)  2SO3 (g) △H1=-197.0kJ•mol-1
2SO3 (g) △H1=-197.0kJ•mol-1
H2O(g)=H2O(l) △H 2=-44.0 kJ·mol-1
2SO2(g) + O2(g) + 2H2O(g) =2H2SO4 (l) △H3=-545kJ•mol-1
则SO3 (g)和H2O(l)反应的热化学方程式为 _________ 。
(7)本工艺流程中可循环物质为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 鉴别NaCl和Na2CO3溶液的试剂是 ,离子方程式为 。
(2) 除去混入Na2CO3溶液中少量NaHCO3杂质的试剂是 ,离子方程式为
。
(3) 除去Fe粉中少量Al粉杂质的试剂是 ,离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是典型的可充电电池,它的正负极极板是惰性材料,
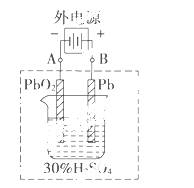
请回答下列问题(不考虑氢、氧的氧化还原):
(1)电解液中H2SO4的浓度将变______________________;
当外电路通过1 mol电子时,理论上负极板的质量增加__________g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成________,B电极上生成____________,此时铅蓄电池的正负极的极性将________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com