
【题目】把2V L含有Na2SO4和MgSO4的混合溶液分成两等份,一份加入含溶质a mol的KOH溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含溶质b mol的BaCl2溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钠离子的浓度为
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
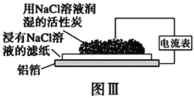
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
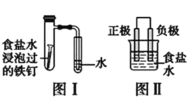
A.按图Ⅰ装置实验,加热具支试管可更快更清晰地得到实验证据—观察到液柱上升
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面白斑可用图Ⅲ装置进行探究,Cl-在铝箔表面区发生电极反应:2Cl- -2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下两组实验:①T1K时,将2mL0.02mol·L-1的酸性KMnO4溶液与2mL0.2mol·L-1草酸溶液混合,观察到溶液完全褪色所需要的时间是4s;②T2K 时,将2mL0.03 mol·L-1的酸性KMnO4溶液与2mL0.2 mol·L-1草酸溶液混合,观察到溶液完全褪色所需要的时间是5s。下列说法正确的是
A.实验①反应速率较快B.实验②反应速率较快
C.无法比较二者反应速率的快慢D.T2—定高于T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,后者刚好是前者两倍的是
A.51 g氧化铝中氧原子数和67.2 L一氧化碳中氧原子数
B.1molCO2的摩尔质量和2 molCO2的摩尔质量
C.50 mL 2 mol·L-1氯化钠溶液中c(Cl-)和50 mL 2 mol·L-1氯化镁溶液中c(Cl-)
D.1molNa2O2固体中阳离子与阴离子比值和1molNa2O固体中阳离子与阴离子比值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙主要用作杀菌剂、防腐剂等,温度在350℃以上容易分解。某同学在实验室中利用纯氧制取少量CaO2,其装置示意图如图:
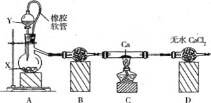
回答下列问题:
(1)制备氧气的方法有多种,若X是MnO2,则Y 是____,若Y是H2O,则A中反应的化学方程式为__。
(2)使用橡皮软管的好处是_____, B中试剂是______.
(3)实验结束时,该同学取少量C中固体置于水中,发现有一种刺激性气味的气体且该气体遇石蕊试液变蓝色,则该气体成分是_______。
(4)为测量产品的纯度,该同学准确称量8.00g产品,然后溶解在足量的KI酸性溶液中,充分反应后再取上述溶液总量的一半,用0.2000 mol·L-1Na2S2O3溶液滴定(I2+2Na2S2O3 =2NaI+Na2S4O6,指示剂为淀粉),滴定终点时消耗了VmL标准溶液。判断滴定 达到终点时的依据是__________,产品中CaO2纯度为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是原子序数依次增大的前四周期主族元素,X能形成多种单质,其中有两种单质硬度差异极大,Z可分别与Y、W、R形成几种常见的二元化合物,其中有两种是大气污染物,R原子最外电子层上有1个电子。
(1) R2Z2的电子式为___, Y、Z、W的简单离子半径由大到小的顺序为______(填离子符号)。
(2) X与Z可形成X2Z、X2Z3两种不常见的气体化合物,X2Z燃烧生成XZ2,写出X2Z与CuO反应的化学方程式_____,X2Z3与水反应生成二元弱酸(H2X2Z4),则X2Z3与NaOH溶液反应的离子方程式为_______。
(3)Y2H4是一种可燃性液体,16.0 gY2H4在氧气中完全燃烧生成一种单质与液态水时可放出312kJ的热量,写出Y2H4燃烧的热化学方程式 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Na2SO4、MgSO4、H2SO4 溶于水配成 0.2 L 混合溶液,部分离子浓度如图 所示,下列说法错误的( )
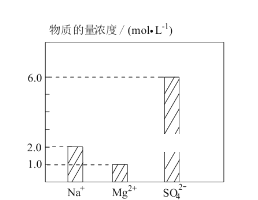
A. 该混合溶液中 Na2SO4 的物质的量为 0.2 mol
B. 该混合溶液中 H+的物质的量浓度为 8mol·L-1
C. 若将该混合溶液加水稀释至体积为 1 L,稀释后溶液中SO42-的物质的量浓度为 1.2 mol·L-1
D. 若向该混合溶液中逐滴加入 2 mol·L-1NaOH 溶液至Mg2+恰好完全沉淀,需 NaOH 溶液 200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是

A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com