
【题目】氢气是一种清洁、高效新能源,也是重要的化工原料。
(1)工业上利用甲烷制备氢气的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
已知:
①H2(g)+![]() O2(g)=H2O(g) △H1=-198kJ/mol
O2(g)=H2O(g) △H1=-198kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-846.3kJ/mol
则CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H4=________。
CO(g)+3H2(g) △H4=________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1
CH3OH(g) △H=-116kJ/mo1
①如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_______,理由_________;Y1_____Y2 (填“<”、“=”、“>”)。
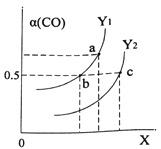
②在2L恒容密闭容器中充入2molCO和4molH2,在一定条件下经过10min达到平衡状态c 点处。则在该条件下,从开始至达到平衡状态v(CH3OH)=________,平衡常数Ka、Kb、Kc的大小关系:____________。
③下列措施既能增大反应速率又能提高反应物的转化率的是_______。
A.使用催化剂 B.及时分离CH3OH C.升高温度 D.增大压强
(3)已知燃料电池的比能量与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由小到大的顺序为___________。
【答案】 +30.7 kJ·mol-1 压强 该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大 < 0.05mol/(L·min) Ka=Kb>Kc D H2>CH4>CH3OH
【解析】(1)根据盖斯定律(③![]() 2-②-①
2-②-①![]() 6)/2: [-846.3
6)/2: [-846.3![]() 2—(-576)-(-198
2—(-576)-(-198![]() 6)]/2=+30.7 kJ·mol-1
6)]/2=+30.7 kJ·mol-1
(2) ①因为CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1,根据方程式分析,温度升高平衡向逆反应方向移动,CO的平衡转化率(α)减小,增大压强,平衡正向移动,CO的平衡转化率(α)增大,图中是随X变化CO的平衡转化率(α)增大的,所以X表示的是压强,理由该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度。答案:压强 ; 该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;<。
CH3OH(g) △H=-116kJ/mo1,根据方程式分析,温度升高平衡向逆反应方向移动,CO的平衡转化率(α)减小,增大压强,平衡正向移动,CO的平衡转化率(α)增大,图中是随X变化CO的平衡转化率(α)增大的,所以X表示的是压强,理由该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度。答案:压强 ; 该反应正向是气体体积减小的反应,增大压强化学平衡有利于正向移动,CO的转化率增大;<。
②根据三段式: CO(g)+ 2H2(g)![]() CH3OH(g) c点CO的平衡转化率为0.5
CH3OH(g) c点CO的平衡转化率为0.5
起始量(mol/l) 1 2 0
变化量(mol/l) 0.5 1 0.5
平衡量(mol/l) 0.5 1 0.5
v(CH3OH)= 0.5 mol.L-/10 min= 0.05mol/(L·min)
因为平衡常数只与温度有关,a b两点同在Y1曲线上,温度相同,所以Ka= Kb。根据因为CO(g)+2H2(g)![]() CH3OH(g) △H=-116kJ/mo1为放热反应,由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度,升温平衡逆向移动,所以Ka=Kb>Kc。
CH3OH(g) △H=-116kJ/mo1为放热反应,由图知压强一定时,Y1的转化率大于Y2所以Y1的温度小于Y2的温度,升温平衡逆向移动,所以Ka=Kb>Kc。
③A.使用催化剂只改变化学反应速率,不能影响平衡移动,也不能改变反应物的转化率,故A不符合题意;B.及时分离CH3OH,减小生成物的浓度,平衡正向移动, 提高反应物的转化率,但化学反应速率降低,故B不符合题意;C.升高温度加快化学反应速率,但升温平衡逆向移动,降低反应物的转化率,故C不符合题意;D.增大压强加快化学反应速率,因为正反应是气体体积减小的反应,所以增大压强,平衡正向移动,反应物的转化率增大,故D符合题意。答案D。
因为燃料电池的比能量与单位质量燃料物质失去的电子数成正比,所以相同质量的H2、CH4、CH3OH的碱性电池转移的电子数为:H2![]() H2O转移的电子数m/2
H2O转移的电子数m/2![]() 2e-=m; CH4
2e-=m; CH4![]() CO2转移的电子数为m/16
CO2转移的电子数为m/16![]() 8e-=m/2;CH3OH
8e-=m/2;CH3OH![]() CO2转移的电子数为m/32
CO2转移的电子数为m/32![]() 6e-=3m/16,所以转移的电子数H2>CH4>CH3OH,其比能量由小到大的顺序为H2>CH4>CH3OH。
6e-=3m/16,所以转移的电子数H2>CH4>CH3OH,其比能量由小到大的顺序为H2>CH4>CH3OH。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________nm.
(3)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是____________。
(4)我国早在春秋战国就开始生产和使用铁器,写出工业上用赤铁矿为原料炼铁的化学方程式:_______________________________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在三个相同且恒容的容器中发生反应 2SO2(g)+O2(g)![]() 2SO3(g)△H=-196kJ/mol,有关数据如下:
2SO3(g)△H=-196kJ/mol,有关数据如下:
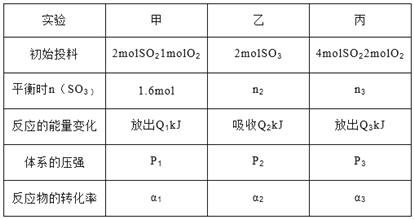
三个容器中反应分别达到平衡时下列数据关系正确的是( )
A. α1+α2= 1 且α3<α1 B. Q1+Q2=196 且 Q3>2Q1
C. n2<n3<3.2mol D. P3>2P1=2P2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶无色溶液,其中可能含有Al3+、Fe2+、Mg2+、Ba2+、K+、Cl-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下:
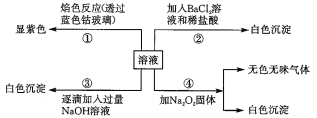
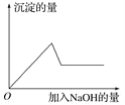
第③个实验中,生成白色沉淀的量与加入NaOH的量有如图所示的相互关系。据此可知:
(1)在原溶液中一定不存在的离子有______________;不能确定是否存在的离子有________。
(2)写出第③个实验中依次发生反应的离子方程式:___________、____________、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),据此回答下列问题:


(1)常温下含碳量最高的气态烃是________(填字母)。
(2)E的一氯取代物同分异构有_______种。
(3)一卤代物种类最多的是________(填写字母)。
(4)能够与Br2发生加成反应的两种气态烃是________(填写字母)。
(5)写出C的加聚反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的说法中,不正确的是( )
A.高压钠灯常用于道路和广场的照明
B.钠钾合金可在快中子反应堆中作热交换剂
C.工业上通过电解氯化钠溶液制取金属钠
D.钠可用于从钛、铌等金属的氯化物中置换出金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选做-选修5: 有机化学基础】PET和PMMA是日常生活常见的两种高分子材料。下列是合成高分子材料的路线:

已知:①RCOOR1+R2OH![]() RCOOR2+R1OH
RCOOR2+R1OH
② (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)
回答下列问题:
(1)物质A的化学名称_______,物质H中官能团的名称________。
(2)由C生成D、I生成J的反应类型分别是_______、_______。
(3)由I生成J的反应中产生六元环的副产物,其结构简式为_______。
(4)写出D+乙二醇→F+G的化学反应方程式________________。
(5)D存在多种同分异构体,其中只含有一种官能团的三取代芳香族化合物且能与碳酸氢钠溶液作用产生气体的同分异构体有____种。
(6)写出用环己醇为原料制备 的合成路线(其他试剂任选)_________。
的合成路线(其他试剂任选)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A是固体金属单质,燃烧时火焰呈黄色。
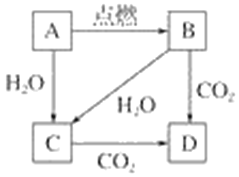
(1)写出下列符号所代表的物质的化学式:
A____________,B____________,C____________,D____________。
(2)写出下列转化的化学方程式:
①A→B________________________________________。
②B→D________________________________________。
③A→C________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧示意图和相关热化学反应如下:
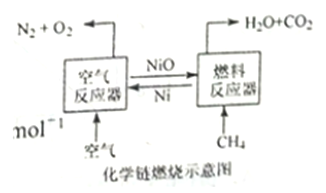
2Ni(s)+O2(g)=2NiO(s)△H=-479.8 kJ·mol-1
CH4(g)+NiO(s)=CO(g)+2H2(g)+Ni(s)△H=akJ·mol-1
CH4(g)+2NiO(s)=CO2(g)+2H2(g)+2Ni(S)△H=b kJ·mol-1
CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s)△H=156.9 kJ·mol-1
下列说法错误的是( )
A. CO2(g)+CH4(g)=2CO(g)+2H2(g) △H=(2a-b) kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.7 kJ·mol-1
C. 甲烷在“燃料反应器”中反应时产生淡蓝色火焰并放出热量
D. 含碳燃料利用“化学链燃烧技术”有利于二氧化碳的分离与回收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com