
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 | |
| D. | 测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热 |
分析 A、浓H2SO4虽然有强氧化性,常温下不与铜反应;
B、铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜;
C、碳酸的酸性强于次氯酸,应用强酸制弱酸;
D、石英坩埚的成份是二氧化硅,二氧化硅是酸性氧化物.
解答 解:A、浓H2SO4虽然有强氧化性,在加热条件能与Cu发生反应,常温下不反应,故A错误;
B、铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜,不属氧化物,故B错误;
C、碳酸的酸性强于次氯酸,所以将CO2通入次氯酸钙溶液可生成次氯酸,故C正确;
D、石英坩埚的成份是二氧化硅,二氧化硅是酸性氧化物,与氢氧化钠反应生成硅酸盐和水,所以不可以将NaOH放入石英坩埚中高温加热,故D错误;
故选C.
点评 本题考查浓硫酸的性质,金属铜的性质,以及酸性的强弱和二氧化硅的性质,注意铜表面长时间在空气中会变质生成的绿色物质是碱式碳酸铜,不属氧化物.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
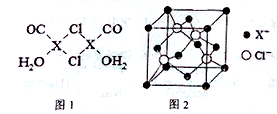 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.
元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O.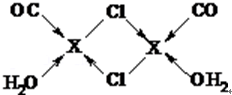 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
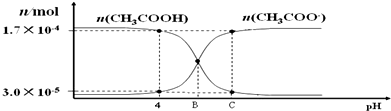
| A. | 醋酸的电离常数的表达式如下Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ | |
| B. | pH=4 时,醋酸的电离常数 Ka≈1.8×10-5 | |
| C. | B点时的溶液中滴入酚酞溶液,显红色 | |
| D. | C点时,c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
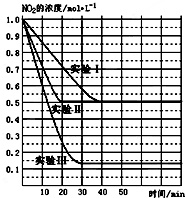 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物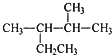 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 | |
| B. | 甲醇、乙醇、甘油互为同系物 | |
| C. | 等物质的量的乙炔、乙醛、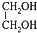 完全燃烧时的耗氧量不相等 完全燃烧时的耗氧量不相等 | |
| D. | 以乙烯为原料制备乙酸乙酯的合成路线可以为: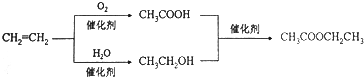 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
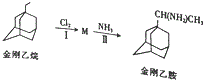 金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.
金刚乙烷、金刚乙胺等已经被批准用于临床治疗人感禽流感,且临床研究表明金刚乙烷比金刚乙胺的副作用小.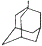 ,如金刚乙烷表示为R-CH2CH3);
,如金刚乙烷表示为R-CH2CH3);
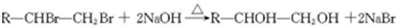 .
.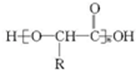 .
.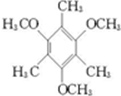 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、X、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛的水溶液具有杀菌、防腐的作用,可用于保存动物标本 | |
| B. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 | |
| C. | 在腌制肉类食品时使用较多量的亚硝酸钠,可使食品较长时间保持红润 | |
| D. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com