
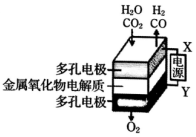
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
分析 A.电解池阴极发生还原反应,根据反应物结合化合价的变化分析;
B.电解池阳极发生氧化反应,阴极发生还原反应,根据与X极相连的电极产生的气体判断;
C.根据图示以及电解的目的解答;
D.根据图示知:阴极产生H2、CO,阳极产生氧气,结合总的反应分析.
解答 解:A.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故A正确;
B.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故B正确;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,故C正确;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D错误;
故选D.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.


科目:高中化学 来源: 题型:实验题
| 实验 | 操作 | 现象 | 结论和解释 |
| 2 | 将SO2通入0.1mol/LFeCl3和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
| 3 | 将SO2通入0.01mol/LHNO3 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O | D. | N2+O2 $\frac{\underline{\;放电\;}}{\;}$ 2NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Br2(g)?2HBr(g) | B. | 2N2O5(g)=4NO2(g)+O2(g) | ||
| C. | 2SO2(g)+O2?2SO3(g) | D. | CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 降低温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 平衡常数:K(200℃)<K(400℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com