
下列与金属腐蚀有关的说法,正确的是( )


A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
科目:高中化学 来源: 题型:
8NH3和NO2在催化剂作用下反应:8NH3+6NO2===7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是( )
A.转移电子2.4NA个
B.生成气体的体积42.56 L(标准状况)
C.还原剂比氧化剂多0.2 mol
D.被还原的氮原子是11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
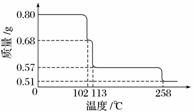
请回答下列问题:
(1)试确定200 ℃时固体物质的化学式________________________________________
________________________________________________________________________;
(要求写出推断过程)。
(2)取270 ℃所得样品,于570 ℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
使用氯化钠作原料可以得到多种产品。
(1)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的物质的量浓度是______________(忽略反应前后溶液体积的变化)。
(2)某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置。

对电源电极名称和消毒液的主要成分判断正确的是________(填字母序号)。
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
(3)实验室中很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。某同学利用上图装置,只更换一个电极,通过电解法制取较纯净的Fe(OH)2沉淀,且较长时间不变色。该同学换上的电解材料是__________(用元素符号表示),总的反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
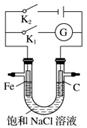
A.K1闭合,铁棒上发生的反应为2H++2e-—→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
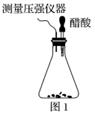
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是________________。

(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能大100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,发生反应:①M(s)+N(g)??R(g) ΔH=-Q1 kJ·mol-1,
②2R(g)+N(g)??2T(g) ΔH=-Q2 kJ·mol-1。Q1、Q2、Q3均为正值。下列说法正确的是( )
A.1 mol R(g)的能量总和大于1 mol M(s)与1 mol N (g)的能量总和
B.将2 mol R(g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ
C.当1 mol M(s)完全转化为T(g)时(假定无热量损失),放出热量(Q1+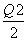 ) kJ
) kJ
D.M(g)+N(g)??R(g) ΔH=-Q3 kJ·mol-1,则Q3<Q1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com