
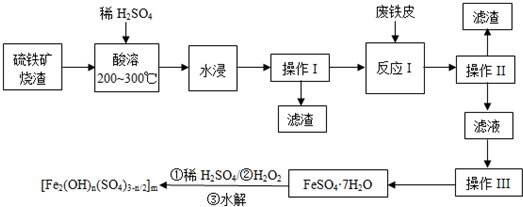
分析 硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m,
(1)根据化合价代数和为0判断聚合硫酸铁中铁元素的化合价;
(2)操作I为过滤,根据过滤操作分析;操作Ⅲ是从硫酸亚铁溶液中获得硫酸亚铁晶体;
(3)Fe3O4溶于硫酸生成硫酸铁和硫酸亚铁;
(4)增大固体的表面积反应速率增大;
(5)酸性条件下H2O2氧化Fe2+为Fe3+,同时生成水;
(6)若硫铁矿烧渣中Fe3O4、Fe2O3、FeO的物质的量之比为1:1:1,且这些氧化物的总物质的量为a mol,则在a mol硫铁矿烧渣中含有+3价的铁为$\frac{4}{3}$amol,根据反应I:2Fe3++Fe=3Fe2+,可计算出反应I消耗铁单质的物质的量.
解答 解:硫铁矿烧渣(主要成分是Fe3O4、Fe2O3、FeO和二氧化硅),加硫酸加热酸溶,水浸,过滤出不溶于酸的二氧化硅,滤液中含有硫酸铁和硫酸亚铁,加废铁皮,Fe与三价铁离子反应生成亚铁离子,过滤去除多余的铁,滤液为硫酸亚铁溶液,然后蒸发浓缩、冷却结晶,得到硫酸亚铁晶体,晶体中加稀硫酸、双氧水得到聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m,
(1)根据化合价代数和为0可知,聚合硫酸铁中铁元素的化合价为+3价,
故答案为:+3,
(2)操作I为过滤,过滤操作用到玻璃仪器有 漏斗、玻璃棒和烧杯等;操作Ⅲ是从硫酸亚铁溶液中获得硫酸亚铁晶体,系列操作名称依次为蒸发浓缩、降温结晶、过滤和洗涤,
故答案为:漏斗;蒸发浓缩、降温结晶;
(3)Fe3O4溶于硫酸生成硫酸铁和硫酸亚铁,反应的化学方程式为:Fe3O4+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+Fe2(SO4)3+4H2O;
故答案为:Fe3O4+4H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$FeSO4+Fe2(SO4)3+4H2O;
(4)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是增大烧渣固体与硫酸的接触的表面积,加快烧渣的溶解速率,
故答案为:增大烧渣固体与硫酸的接触的表面积,加快烧渣的溶解速率;
(5)酸性条件下H2O2氧化Fe2+为Fe3+,同时双氧水被还原生成水,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(6)若硫铁矿烧渣中Fe3O4、Fe2O3、FeO的物质的量之比为1:1:1,且这些氧化物的总物质的量为a mol,则在a mol硫铁矿烧渣中含有+3价的铁为$\frac{4}{3}$amol,根据反应I:2Fe3++Fe=3Fe2+,可知铁单质的物质的量为$\frac{4}{3}a×\frac{1}{2}$mol=$\frac{2}{3}$amol,
故答案为:$\frac{2}{3}$a.
点评 本题考查制备实验方案的设计与评价,题目难度较大,准确的分析流程、明确铁及其化合物的性质是解题的关键,侧重学生分析能力和创新能力的培养.


科目:高中化学 来源: 题型:多选题
| A. | 8.5 | B. | 17 | C. | 16 | D. | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | B. | 氨气分子的球棍模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 硫化氢分子的电子式: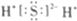 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制盐酸溶液,用量筒取盐酸时俯视刻度线 | |
| B. | 配制盐酸溶液定容时,仰视容量瓶 | |
| C. | 称量4gNaOH配制0.20mol/L NaOH溶液500mL时,砝码错放左盘 | |
| D. | 配制NaOH溶液时,溶液未经冷却即注入容量瓶并定容至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液都是均一、稳定的分散系,静置不易产生沉淀 | |
| B. | 胶体与纳米级微粒在直径上具有相同数量级 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 向Fe(OH)3胶体中逐滴加入稀硫酸无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com