
����Ŀ����ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ��285.8kJmol��1����283.0kJmol��1�ͩ�726.5kJmol��1 �� ��ش��������⣺
��1����̫���ֽܷ�10molˮ���ĵ������� kJ��
��2���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
��3����ֱ���Լ״�Ϊȼ�ϵĵ���У�����״̬�£���ȼ�ϵ������1mol�״����ܲ�����������Ϊ702.1kJ�����ȼ�ϵ�ص�����Ч��Ϊ��ȼ�ϵ�ص�����Ч����ָ�����������������ռȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ�������İٷֱȣ���
���𰸡�
��1��2858
��2��CH3OH��l��+O2��g���TCO��g��+2H2O��l����H=��443.5kJ?mol��1
��3��96.6%
���������⣺��1����H2��g����ȼ���ȡ�HΪ��285.8kJmol��1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ�����ֽ�1mol H2O��l��Ϊ1mol H2��g�����ĵ�����Ϊ285.8kJ����ֽ�10mol H2O��l�����ĵ�����Ϊ285.8kJ��10=2858kJ�����Դ��ǣ�2858��
��2����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ��283.0kJmol��1�ͩ�726.5kJmol��1 �� ���CO��g��+1/2O2��g��=CO2��g����H=��283.0kJmol��1��CH3OH��l��+3/2O2��g��=CO2��g��+2 H2O��l����H=��726.5kJmol��1
�ɸ�˹���ɿ�֪�âک��ٵ÷�ӦCH3OH��l��+O2��g��=CO��g��+2 H2O��l�����÷�Ӧ�ķ�Ӧ�ȡ�H=��726.5kJmol��1������283.0kJmol��1��=��443.5kJmol��1 �� ���Դ��ǣ�CH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=��443.5kJmol��1��
��3��CH3OH��l����ȼ���ȡ�H�ǩ�726.5kJmol��1 �� ��֪1mol�״���Ӧ�ų�������Ϊ725.6kJ�����ȼ�ϵ�ص�����Ч��Ϊ ![]() ��100%=96.6%�����Դ��ǣ�96.6%��
��100%=96.6%�����Դ��ǣ�96.6%��


 С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д� ��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
��У��ʦ������ҵ���Ӻ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ��Һ��c(H��)��c(OH��)����ͼ��ʾ��ϵ��
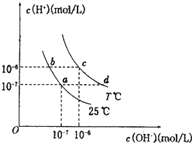
�������������������ӹ���˵������ȷ����
A. d���Ӧ����Һ�д������ڣ�Na����K����S������SO3����
B. b���Ӧ����Һ�д������ڣ�NH4+��K+��I����NO3-
C. c���Ӧ����Һ�д������ڣ�Na����Fe3+��SO42-��Cl��
D. a���Ӧ����Һ�д������ڣ�Fe2+��Ca2����ClO����SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ģ�ҵ�ϳɰ������Ʊ�NaHCO3�����ʵ������(�г�װ����ȥ)��
�ش��������⣺

(1)װ��E��ʢ�ż�ʯ�ҵ���������Ϊ_____________________________��
(2)װ��A�з�����Ӧ�����ӷ���ʽΪ___________________________________________________��
(3)װ��C������ΪʹN2��H2��Ͼ���______________________��_________________________��
(4)ʵ��ʱ��Ӧ�ȴ�װ��B�з�Һ©����������Ӧһ��ʱ�䣬��װ��ĩ�˵��ܴ��ռ�H2���鴿���ٵ�ȼD���ƾ��ƣ�ԭ��Ϊ___________________________________________________________��
(5)��F�еİ������ͺ�ȡ��װ��F����������ͨ������CO2������Ϊ______________________��������Ӧ�����ӷ���ʽΪ______________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���У�U����Ϊ��īˮ��a��b�Թ��ڷֱ�ʢ��ʳ��ˮ���Ȼ����Һ����֪�Ȼ����Һ�����ԣ��������������飬����һ��ʱ�䣮�����й�����������ǣ� �� 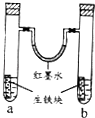
A.�������е�̼��ԭ��ص�����
B.��īˮ�����ߵ�Һ���Ϊ����Ҹ�
C.���Թ�����ͬ�ĵ缫��Ӧʽ�ǣ�Fe��2e��=Fe2+
D.a�Թ��з�����������ʴ��b�Թ��з��������ⸯʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ���������������Ⱦ�Ϲ�ҵ��ij��ȤС�����Ʊ�Ca(NO2)2���������ʽ���̽����
�������زġ�
����NO+NO2+Ca(OH)2Ca(NO2)2+H2O��
����Ca(NO2)2�ܱ�����KMnO4��Һ������![]() ��
�� ![]() ����ԭΪMn2+��
����ԭΪMn2+��
������������������Ca(NO2)2�ܽ�I����ΪI2�� ![]() �ܽ�I2��ԭΪI��
�ܽ�I2��ԭΪI��
���Ʊ��������
��1������ͬѧ����������ͼ��ʾװ���Ʊ��������
![]()
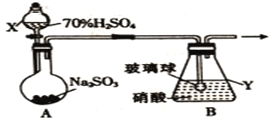
������X��������_______________�����Ʊ���������ǰҪ��____________________________��
��װ��B���ݳ���NO��NO2�����ʵ���֮��Ϊ1��1����װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ____________________________________________________���������������䣬���������Ũ�ȣ����ʹ�ݳ���������n(NO2)__________n(NO)(����>������<������
���Ʊ�Ca(NO2)2��
��2������ͬѧ������װ��B�в����ĵ��������Ʊ�Ca(NO2)2��װ����ͼ��
![]()
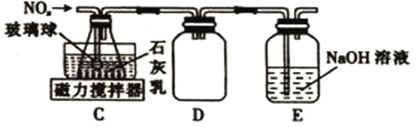
��װ��C�е���ĩ�˽�һ��ײ������������______________________________________��
��װ��D��������_______________________��װ��E��������______________________��
���ⶨCa(NO2)2�Ĵ��ȡ�
��3������ͬѧ���õζ����ⶨCa(NO2)2�Ĵ���(���ʲ��μӷ�Ӧ)���ɹ�ѡ����Լ���
a��ϡ���� b��c1 mol��L1��KI��Һ c��������Һ
d��c2 mol��L1��Na2S2O3��Һ e��c3 mol��L1������KMnO4��Һ
������Ca(NO2)2�Ļ�ԭ�����ⶨ�䴿�ȣ���ѡ����Լ���________________(����ĸ)��
������Ca(NO2)2�����������ⶨ�䴿�ȵIJ��裺ȷ��ȡm g Ca(NO2)2��Ʒ������ƿ�У�������ˮ�ܽ⣬����______________________________��Ȼ��μ�ϡ���ᣬ��c2 mol��L1��Na2S2O3��Һ�ζ�����Һ��ɫ��________________________���Ұ�����ڲ���ɫ����ȡ����Na2S2O3��Һ�������Ϊ��������__________________________________________(�벹������ʵ�鲽��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���仯��������������������������أ�
��1���ڻ������������У�����CO�Ĵ��ڻ���������ж���Ϊ�˷�ֹ�����ж�������SO2��CO������SO2����ԭΪS��
��֪��C��s��+ ![]() O2��g��=CO��g����H1=��126.4kJmol��1
O2��g��=CO��g����H1=��126.4kJmol��1
C��s��+O2��g��=CO2��g����H2=��393.5kJmol��1
S��s��+O2��g��=SO2��g����H3=��296.8kJmol��1
��SO2����CO���Ȼ�ѧ��Ӧ����ʽΪ
��2��һ������COȼ�ϵ�ع���ԭ����ͼ��ʾ��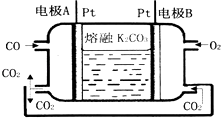
�ٸ����缫��Ӧʽ���������缫��Ӧʽ�� ��
�ڵ缫A��������CO2�в��ֲ���ѭ�����ã���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ʵ�飬�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D |
|
|
|
|
β������������NO2 | �Ʊ����� | ��֤���������ⸯʴ | ��֤���ԣ� CH3COOH>H2CO3> Al(OH)3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ķ����л���������п�ۺ�����ͭ(�����ɷֲ����ᷴӦ)��������������Ӵ��γ���ˮ������������������ˮ�����������ҷ�Ӧ��������ʣ�࣬��ʱ��ˮ��һ�����еĽ����������� ��
A��Fe2+��Cu2+ B��Cu2+��H+ C��Zn2+��Fe2+ D��Zn2+��H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 1 mol NO2 ������Ϊ46g/mol
B. NO2��Ħ������Ϊ46g
C. NO2��Ħ����������NO2����Է�������
D. NA��NO2��������NO2����Է�����������ֵ����ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com