
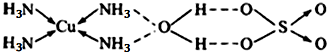
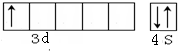
 ,
, ;
;

科目:高中化学 来源: 题型:
A、2Fe(OH)3
| ||||
| B、Fe+CuSO4=Cu+FeSO4 | ||||
| C、Fe(OH)3+3HCl=FeCl3+3H2O | ||||
D、2Fe2O3+3C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A、离子半径:T<W<G |
| B、等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
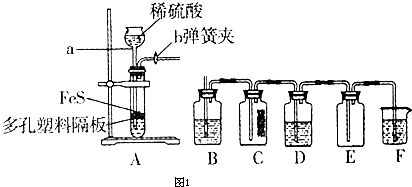

| 实验操作 | 实验现象 | |
| 实验l | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
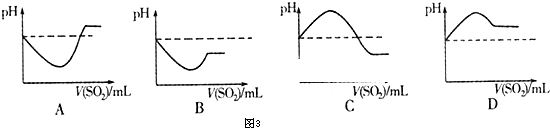
查看答案和解析>>
科目:高中化学 来源: 题型:
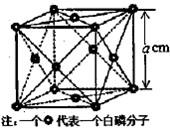 氮族元素包括N、P、As、Sb和Bi五种元素.
氮族元素包括N、P、As、Sb和Bi五种元素.查看答案和解析>>
科目:高中化学 来源: 题型:
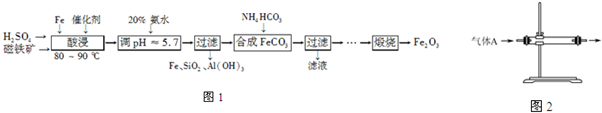
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com