
下列方法中可以证明2HI(气)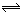 H2(气)+I2(气)已达平衡状态的是
H2(气)+I2(气)已达平衡状态的是
① 单位时间内生成n mol H2的同时生成n mol HI
② 一个H-H键断裂的同时有两个H-I键断裂
③温度和压强一定时混合气体密度不再变化
④ 反应速率υ(H2)=υ(I2)=0.5υ(HI)时
⑤ c(HI)=c(H2)=c(I2)=2:1:1
⑥ 温度和体积一定时,某一生成物浓度不再变化
⑦ 温度和体积一定时,容器内压强不再变化
⑧ 条件一定,混合气体的平均相对分子质量不再变化
⑨ 温度和体积一定时混合气体的颜色不再变化
| A.②③④⑤⑥ | B.②⑥⑦⑧⑨ | C.①②⑥⑧ | D.②⑥⑨ |
D
解析试题分析:A、③该反应是反应前后气体的物质的量不变的反应,所以温度和压强一定时混合气体密度始终不变,④未指明正逆反应,⑤三种物质的浓度比符合系数比时不一定是平衡状态,不能作为平衡状态的标志,错误;B、⑦温度和体积一定时,容器内压强始终不变,⑧ 条件一定,混合气体的平均相对分子质量始终不变,不能作为平衡状态的标志,错误;C、①单位时间内生成n mol H2的同时生成n mol HI,不符合化学方程式中的系数比,错误;D、② 一个H-H键断裂的同时有两个H-I键断裂,⑥ 温度和体积一定时,某一生成物浓度不再变化,符合化学平衡的定义,⑨ 温度和体积一定时混合气体的颜色不再变化,说明碘的浓度不再变化,可以作为平衡状态的标志,正确,答案选D。
考点:考查化学平衡状态的判断


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:计算题
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:① 2C(焦炭)+O2(空气)=2CO;② Fe2O3+3CO=2Fe+3CO该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需其主要原因是
| A.CO过量 | B.CO与铁矿石接触不充分 |
| C.炼铁高炉的高度不够 | D.CO与Fe2O3的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在温度不变的条件下,在恒容的容器中进行下列反应: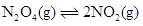 。若
。若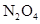 的浓度由
的浓度由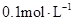 降到
降到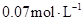 需要15s,那么
需要15s,那么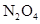 的浓度由
的浓度由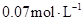 降到
降到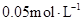 所需的反应时间( )
所需的反应时间( )
| A.等于5s | B.等于10s | C.大于10s | D.小于10s |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在10L密闭容器中,A、B、C三种气态物质构成可逆反应体系,其关系如图所示。下列说法错误的是( )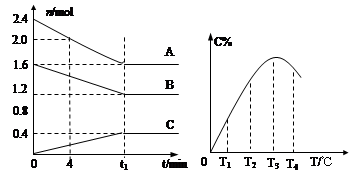
A.0~4分钟时,A的平均反应速率为 0.01mol·L-1·min-1
B.由T1向T2变化时,V正>V逆
C.此反应的正反应为吸热反应
D.其它条件不变,加压,达新平衡时,C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X(g)+3Y(g)═ 2Z(g)△H>0,下列对该反应的说法中正确的是
| A.△S>0 |
| B.逆向能自发进行,且反应速率和平衡常数均较大 |
| C.反应物总能量大于生成物总能量 |
| D.在任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,当反应达到平衡时,下列说法正确的是( )
| A.18O只存在于乙酸乙酯中 | B.18O存在于水、乙酸、乙醇以及乙酸乙酯中 |
| C.18O存在于乙酸乙酯、乙醇中 | D.若与丙酸反应生成酯的相对分子质量为102 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com