
| 事实 | 结论 | |
| A | A原子、B原子价电子数分别为1、2 | A的金属性一定比B的强 |
| B | 某气态单质X与H2通常条件下不能共存 | 在化合物中,X元素只能呈负价 |
| C | 元素的非金属性M>N | 含氧酸的酸性M>N |
| D | Q分子间存在氢键而P分子间无氢键 | Q的沸点一定比P的高 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.金属性强弱与失去电子难易有关,与价电子数目多少无关;
B.某气态单质X与H2通常条件下不能共存,则X为氟气;
C.非金属性越强,最高价含氧酸的酸性越强,若不是最高价含氧酸,酸性强弱不一定;
D.分子间存在氢键可以使物质的沸点升高,但分子间作用力也影响物质的沸点.
解答 解:A.金属性强弱与失去电子难易有关,与价电子数目多少无关,如Na的金属性比Mg的强,故A错误;
B.某气态单质X与H2通常条件下不能共存,则X为氟气,F元素电负性最大,在化合物中F元素只能呈负价,故B正确;
C.非金属性越强,最高价含氧酸的酸性越强,若不是最高价含氧酸,酸性强弱不一定,如非金属性Cl>S,而HClO为弱酸,硫酸为强酸,故C错误;
D.分子间存在氢键可以使物质的沸点升高,但分子间作用力也影响物质的沸点,分子间存在氢键的物质沸点不一定高于分子间无氢键的物质,如H2Te的沸点高于氨气,故D错误,
故选:B.
点评 本题考查结构与性质关系、元素化合物性质、元素周期律、氢键等,需要学生熟练掌握基础知识,难度不大.


科目:高中化学 来源: 题型:解答题
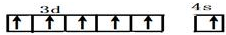 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 水解:Al3++3H2O═Al(OH)3 +3H+ | |
| B. | NaHCO3 电离:NaHCO3 ?Na++HCO3- | |
| C. | 固体Ca(OH)2 与NH4Cl共热:NH4++OH-═NH3+H2O | |
| D. | 过量的CO2 气体通入饱和石灰水中:CO2 +OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:2 | D和E 1:3 | B和E 1:4 |
 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- | |
| B. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Cu+Fe3+=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 L 0.l mol•L-1的Na2CO3溶液中离子总数一定大于3NA | |
| B. | 标准状况下,22.4 L HF的分子数为NA | |
| C. | 1 mol Fe在22.4 L的Cl2(标准状况下)中燃烧,转移的电子总数为3NA | |
| D. | 一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com