

分析 ClO2不便于运输、易爆炸、不稳定,工业上采用2NaClO3+H2O2+H2SO4=2ClO2+O2↑+Na2SO4+2H2O、2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2,制备NaClO2,使用时再释放出来,据此图示流程:反应器1水浴、反应容器2中放入硫酸、30%过氧化氢、氯酸钠,制备ClO2,ClO2易溶于水,熔点为-59.5℃,沸点为11℃,装置3冷凝,反应器4中2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2,制备NaClO2,装置5缓冲,防止吸收液直接进入真空泵,真空泵抽气而获得反应体系真空条件.
(1)根据题干信息和图示物质,反应容器2中放入硫酸、30%过氧化氢、氯酸钠,所以采用H2O2、H2SO4和NaClO3反应,制备ClO2,据此信息确定反应物和生成物,并根据得失电子守恒和原子守恒书写方程式;
(2)根据制备NaClO2的工艺装置图可知,装置3从下向上进水,为冷凝装置;
(3)吸收瓶中二氧化氯和过氧化氢在碱性条件下反应生成NaClO2,选择低温是因为反应物过氧化氢温度高会分解,影响产率,也可选择增大反应物氢氧化钠的浓度促进吸收;
(4)根据装置5特点以及在流程图中的位置分析确定其用途;
(5)由滴定发生的方程式:2Na2S2O3+I2=2NaI+Na2S4O6,4I++ClO2-+4H+=2I2+Cl-+3H2O,可得关系式ClO2-~2I2~4Na2S2O3据此计算NaClO2的质量分数;
(6)氯气、氯化氢有毒,结合R5(kesting法)的制备原理分析.
解答 解:(1)根据工艺装置图中物质的信息可知,反应物为H2O2、H2SO4和NaClO3,生成物为ClO2,氯的化合价降低,过氧化氢中-1价的氧化合价升高,所以产物中有氧气,根据得失电子守恒和原子守恒,反应方程式为:2NaClO3+H2O2+H2SO4=2ClO2+O2↑+Na2SO4+2H2O,
故答案为:2NaClO3+H2O2+H2SO4=2ClO2+O2↑+Na2SO4+2H2O;
(2)装置3从下向上进水,ClO2易溶于水,熔点为-59.5℃,沸点为11℃,所以装置3为冷凝装置,
故答案为:B;
(3)吸收瓶中二氧化氯和过氧化氢在碱性条件下反应:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2,温度过高,过氧化氢会分解,所以选择低温条件,也可选择增大反应物氢氧化钠的浓度促进吸收,
故答案为:2ClO2+H2O2+2NaOH=2NaClO2+2H2O+O2;温度过高,过氧化氢会分解;增大氢氧化钠的浓度;
(4)装置5处在吸收瓶和真空泵之间,起缓冲作用,防止吸收液直接进入真空泵,
故答案为:缓冲,防止吸收液直接进入真空泵;
(5)根据c步骤.滴定发生的方程式:2Na2S2O3+I2=2NaI+Na2S4O6,2Na2S2O3~I2反应生成的碘单质的物质的量为:n(I2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×C×(V-V0)×10-3mol/L,
由4I++ClO2-+4H+=2I2+Cl-+3H2O可知ClO2-~2I2,步骤a.称量约mg亚氯酸钠,配成500.00mL溶液,n(NaClO2)=$\frac{1}{2}$n(I2)=$\frac{1}{4}$×C×$\frac{500}{25}$×(V-V0)×10-3mol/L,
所以NaClO2的质量为:m(NaClO2)=nM=$\frac{1}{4}$×C×$\frac{500}{25}$×(V-V0)×10-3mol/L×90.5g/mol═$\frac{1}{4}$×C×$\frac{500}{25}$×(V-V0)×10-3×90.5g,所以NaClO2的质量分数为:$\frac{(V-{V}_{0})×C×\frac{90.5}{4}×1{0}^{-3}}{m×\frac{25}{500}}×100%$,
故答案为:$\frac{(V-{V}_{0})×C×\frac{90.5}{4}×1{0}^{-3}}{m×\frac{25}{500}}×100%$;
(6)制备NaClO2的工艺未使用易挥发的酸,没有易挥发的污染物,而用R5(kesting法,原理为:2NaClO3+4HCl=2ClO2+Cl2↑+2NaCl+2H2O)制ClO2,氯气、氯化氢有毒且易挥发,对环境污染大,所以相比R5法,过氧化氢对环境污染小,
故答案为:对环境污染小.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 硝酸铵、氰化钠、电石和金属钠均属于电解质 | |
| B. | CN-中C元素显+2价,N元素显-3价,则非金属性N>C | |
| C. | 氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡 | |
| D. | 电石属于危化品中的遇湿易燃固体,需贴上右图标志,其着火时不能用水灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
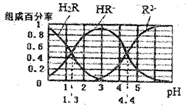
| A. | 在pH=4.4的溶液中:3c(HR-)=c(Na+)+c(H+)-c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2R溶液混合后,溶液中水的电离程度比纯水小 | |
| C. | 在pH=3的溶液中存在 $\frac{c({R}^{2-})×c({H}_{2}R)}{c(H{R}^{-})^{2}}$=10-3.1 | |
| D. | 向Na2CO3溶液中加入少量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
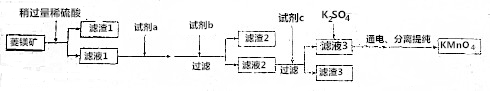
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
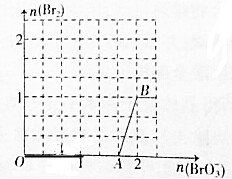
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
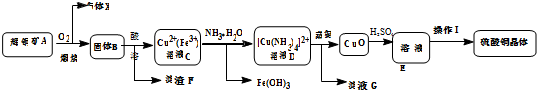

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml0.1mol/L HCl溶液混合后溶液呈酸性,所得溶中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com