
| A. | 铁表面镀锌,锌作阳极 | |
| B. | 船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
分析 A、在铁表面镀锌,需要将锌先反应为锌离子,然后在铁表面析出;
B、在原电池中,活泼的做负极;
C、钢铁的吸氧腐蚀中,正极上氧气放电;
D、电解饱和食盐水时,阳极上氯离子放电.
解答 解:A、在铁表面镀锌,需要将锌先反应为锌离子,然后在铁表面析出,故锌应做阳极,故A正确;
B、在原电池中,活泼的做负极,与轮船形成原电池,船体做正极被保护,故B错误;
C、钢铁的吸氧腐蚀中,正极上氧气放电,电极反应为:O2+2H2O+4e-═4OH-,故C正确;
D、电解饱和食盐水时,阳极上氯离子放电,电极反应为2Cl--2e-═Cl2↑,故D正确.
故选B.
点评 本题考查了电化学腐蚀与防护,应注意的是在原电池中正极被保护、在电解池中阴极被保护,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CuCl2 NH4Cl Fe2(SO4)3 NaNO3 | |
| B. | (NH4)2SO4 CuSO4 Na2CO3 FeCl3 | |
| C. | Cu(NO3)2 NH4 NO3 FeCl3 H2S | |
| D. | Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| B. | FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | Fe3O4与HCl:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | Fe2O3与Hl:Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=CH2 | B. | CH3COOH | C. | CH2=CHClC=CH2 | D. | CH2=CHCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
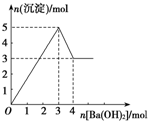 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO4 | B. | KAl(SO4)2 | C. | Al2(SO4)3 | D. | Na AlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
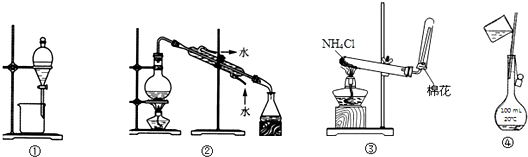
| A. | 选①可用于CC14提取碘水中的碘 | |
| B. | 选②可用于自来水制取蒸馏水 | |
| C. | 选③可用于实验室制取氨气 | |
| D. | 选④可用于配制100 mL 0.1 mol/L NaCl溶液(转移溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com