
(13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡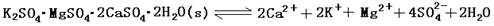
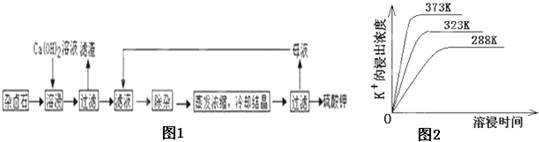
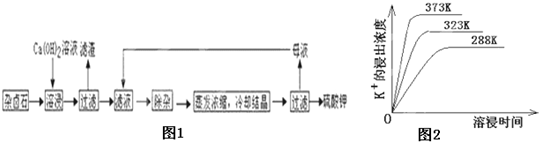
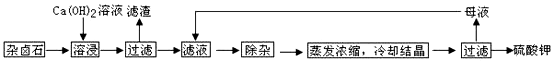
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
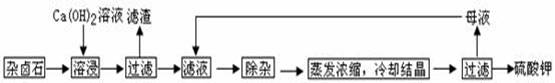
(1)滤渣主要成分有 和 以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: 。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性。
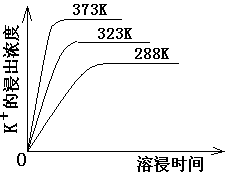
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高,
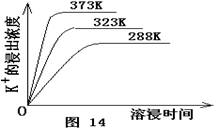
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:

已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5 ,求此温度下该反应的平衡常数K 。
(1)CaSO4 (1分) Mg(OH)2(1分)
(2)氢氧根与镁离子结合,使平衡向右移动,K+变多。(2分)
(3)K2CO3 (2分) H2SO4 (2分)
(4)①③(2分)
(5)K=1.75×104(3分)
【解析】
试题分析:(1)根据题目给出的可逆溶解平衡,加Ca(OH)2后,Mg 2+变成Mg(OH)2,硫酸钙是微溶物,因此滤渣成分是Mg(OH)2,CaSO4和未溶杂卤石;(2)根据勒夏特列原理,加入Ca(OH)2后,Mg 2+不断沉淀,硫酸钙也析出,平衡正移,因此浸出K+;(3)为了使生成的硫酸钾最纯,要除去加入的过量的氢氧化钙,而进入杂质阳离子,因此加入碳酸钾,最后硫酸钾除去过量的碳酸钾且调节溶液pH值;(4)由已知曲线图观察可知,升高温度可以提高K+浸出率,缩短浸出时间;(5)由题意知:Ksp(CaCO3)=2.80×10-9= c(Ca2+)·c(CO32-),Ksp(CaSO4)=4.90×10-5= c(Ca2+)·c(SO42-),因此有:Ksp = 1.75×104。
考点:化学反应平衡原理。
点评:本题在化学工艺流程的背景下对化学反应平衡进行考查,题目难度比较大,综合性较强。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| SO | 2- 4 |
| CO | 2- 3 |
| SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市重庆一中高二上学期期中考试理科化学试卷(带解析) 题型:填空题
(13分)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡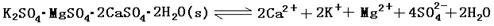
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下: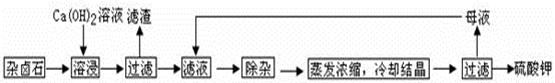
(1)滤渣主要成分有 和 以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: 。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液PH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图14,由图可得,随着温度升高, 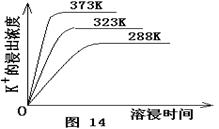
① 在相同时间K+的浸出浓度大。
② 在相同时间K+的浸出浓度减小
③ 反应的速率加快,平衡时溶浸时间短。
④ 反应速率减慢,平衡时溶浸时间增长。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
已知298K时, Ksp(CaCO3)=2.80×10—9, Ksp(CaSO4)=4.90×10—5 ,求此温度下该反应的平衡常数K 。
查看答案和解析>>
科目:高中化学 来源:广东 题型:问答题
| SO | 2-4 |
| CO | 2-3 |
| SO | 2-4 |
查看答案和解析>>
科目:高中化学 来源:广东省高考真题 题型:填空题
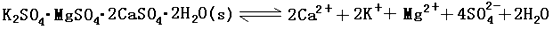
 已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
已知298K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com