
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率ν(Z)=2.0×10-5 mol/(L•min) | |
| B. | 4min时,ν(逆)>ν(正) | |
| C. | 该温度下,此反应的平衡常数K=1.44 | |
| D. | 7min时,反应还未达到平衡状态 |
分析 A、2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,求出Z的物质的量变化,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(Z);
B、根据4min时的浓度变化分析,反应进行到7minY的物质的量减小,说明反应正向进行;
C、由表中数据可知7min时,反应到达平衡,根据平衡时Y的物质的量,利用三段式计算平衡时其它组分的物质的量,由于反应气体氢气的化学计量数相等,用物质的量代替浓度代入平衡常数表达式计算;
D、数据分析可知7min,到9min,Y的物质的量不变,说明此时反应已达到平衡状态.
解答 解:A、由表中数据可求得2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,则前2min内生成Z为0.08mol,故v(Z)=$\frac{\frac{0.08mol}{10L}}{2min}$=4×10-3mol/(L•min),故A错误;
B、4min时,n(Y)=0.11mol,7min时n(Y)=0.10mol,是说明随时间增长,Y的物质的量减小,说明反应正向进行,ν(逆)<ν(正),故B错误;
C、由表中数据可知7min时,反应到达平衡,Y的物质的量为0.10mol,此时X的物质的量也为0.10mol,Z的物质的量也为0.12mol,X、Y、Z的物质的量浓度分别为:0.01mol•L-1、0.01mol•L-1、0.012mol•L-1,故平衡常数K=$\frac{{c}^{2}(Z)}{c(X)c(Y)}$=$\frac{0.01{2}^{2}}{0.01×0.01}$=1.44,故C正确;
D、数据分析可知7min到9min,Y的物质的量不变,说明7min时,反应已达到平衡状态,故D错误.
故选C.
点评 本题考查化学反应速率、化学平衡常数、化学平衡的影响因素等,难度中等,注意C选项中对化学平衡常数的理解.


科目:高中化学 来源: 题型:选择题
| A. | 9gH2O中含有NA个电子 | |
| B. | 标准状况下,22.4L乙醇中含有2NA个碳原子 | |
| C. | 25℃,0.2mol•L-1CH3COONa溶液含有0.2NA个CH3COO- | |
| D. | 2.4g镁在空气中充分燃烧生成MgO和Mg3N2,转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
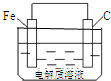 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题: .
.| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂 | B. | 增大A物质的浓度 | C. | 增大B物质的浓度 | D. | 减少C物质的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
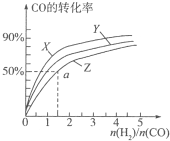 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验表面实验室可用氨水洗涤银镜反应后的试管 | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| D. | 由资料信息科推知:加浓硝酸后生成的沉淀为AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量增加 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| D | ||
| A | B | C |
| E |
| A. | 5Z | B. | 5Z+8 | C. | 5Z+10 | D. | 5Z+18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com