
| A. | SO2 | B. | MgO | C. | H2O | D. | CO2 |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | B. |  称取氯化钠 | C. |  液体加热 | D. |  量取9.5mL的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
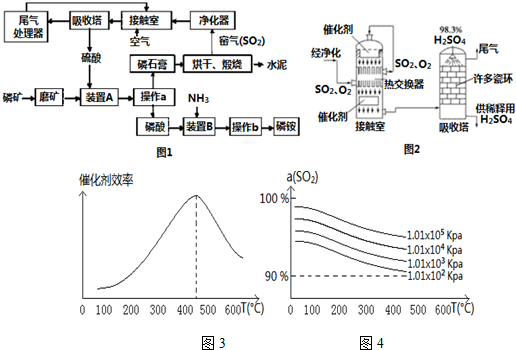
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体 | |
| B. | 将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中 | |
| C. | 定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些 | |
| D. | 摇匀后发现凹液面最底点低于刻度线,再补加蒸馏水到凹液面最底点与刻度线相平 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 各组成元素质量分数相同的烃是同一种烃 | |
| B. | 结构相似,组成上相差一个或若干个CH2原子团的有机物是同系物 | |
| C. | 能使溴的四氯化碳溶液褪色的烃一定是烯烃 | |
| D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com