
| A. | 原子序数 d>c>b>a | |
| B. | 单质的还原性D<C<B<A | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,由于原子形成阳离子失去一个电子层,原子形成阴离子电子层不变,故A、B处于第三周期,C、D处于第二周期,结合电荷可推知A为Mg、B为Na、C为N、D为F.
A.核外电子数相等,则a-2=b-1=c+3=d+1,据此判断原子序数;
B.金属性越强,单质还原性越强,非金属性越强,单质氧化性越强;
C.电子层结构相同,核电荷数越大离子半径越小;
D.氢氧化镁的碱性比NaOH弱,硝酸溶液为酸性.
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,由于原子形成阳离子失去一个电子层,原子形成阴离子电子层不变,故A、B处于第三周期,C、D处于第二周期,结合电荷可推知A为Mg、B为Na、C为N、D为F.
A.核外电子数相等,则a-2=b-1=c+3=d+1,故原子序数:a>b>d>c,故A错误;
B.金属性Mg<Na,故还原性Mg<Na,非金属性N<F,故氮气氧化性比氟气弱,故B错误;
C.核电荷数:A>B>D>C,电子层结构相同,核电荷数越大离子半径越小,故离子半径:C3->D->B+>A2+,故C正确;
D.氢氧化镁、氢氧化钠呈碱性,氢氧化镁难溶于水,碱性比NaOH弱,硝酸溶液为酸性,故pH值B>A>C,故D错误,
故选:C.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,结合离子所带电荷确定元素,熟练掌握元素周期律的递变规律.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L HCl时所得的盐酸浓度不是1 mol/L,只有当22.4 L HCl溶于水制得1 L盐酸时,其浓度才是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol/L的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纳米碳(粒子直径为1~100nm的材料)均匀地分散到蒸馏水中,所形成的体系是胶体 | |
| B. | 氢氧化铁胶体带正电,所以进行电泳实验时,阴极区域颜色加深 | |
| C. | 可以用丁达尔效应区分氢氧化铁胶体和碘水 | |
| D. | 明矾和硫酸铁的净水原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
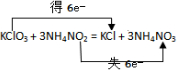 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| B. | 1 mol羟基(-OH)所含的电子总数为9NA | |
| C. | 14g乙烯、丙烯的混合气体中所含原子总数为3NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com