
【题目】工业上常用如下的方法从海水中提溴:
浓缩海水![]() 粗溴
粗溴![]() 溴蒸气
溴蒸气![]() 物质X
物质X![]() 产品溴
产品溴
完成下列填空:
(1)上述流程中有两步都涉及到氯气。氯气分子中所含的化学键名称是:______,溴单质的电子式是:______,溴和氯气态氢化物的沸点比较:______![]() ______
______![]() 填写化学式
填写化学式![]() ,写出一种含氯元素的化合物且属于非极性分子的化学式______。
,写出一种含氯元素的化合物且属于非极性分子的化学式______。
(2)步骤②中体现了溴单质具有的性质是______。
(3)写出步骤③中反应的化学方程式并标出电子转移的方向和数目。![]() 说明:反应有水参与且有硫酸生成
说明:反应有水参与且有硫酸生成![]() :______;在该反应中被氧化的元素是:______。
:______;在该反应中被氧化的元素是:______。
(4)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:______和______![]() 写化学式
写化学式![]() 。
。
【答案】共价键 ![]() HBr HCl
HBr HCl ![]() 沸点低,易挥发
沸点低,易挥发 ![]() S NaOH
S NaOH ![]()
【解析】
浓缩后增大溴离子的浓度,与氯气发生![]() ,用空气和水蒸气将溴吹出,并用
,用空气和水蒸气将溴吹出,并用![]() 氧化吸收,从而达到富集溴,③中发生
氧化吸收,从而达到富集溴,③中发生![]() ,④中发生
,④中发生![]() ,
,
(1)氯气分子中氯原子间相处一对共用电子对,形成一个共价键,氯原子核外17个电子,溴单质是溴原子间形成一对共用电子对,电子式:![]() ,氢化物沸点和相对分子质量有关,相对分子质量越大,沸点越高,溴和氯气态氢化物的沸点比较为:
,氢化物沸点和相对分子质量有关,相对分子质量越大,沸点越高,溴和氯气态氢化物的沸点比较为:![]() ,含氯元素的化合物且属于非极性分子的为四氯化碳,化学式:
,含氯元素的化合物且属于非极性分子的为四氯化碳,化学式:![]() ,
,
故答案为:共价键;![]() ;HBr,HCl;
;HBr,HCl;![]() ;
;
(2)步骤②中用空气和水蒸气将溴吹出,并用![]() 氧化吸收,从而达到富集溴,体现了溴具有的性质是沸点低,易挥发,
氧化吸收,从而达到富集溴,体现了溴具有的性质是沸点低,易挥发,
故答案为:沸点低,易挥发;
(3)步骤③中反应是溴单质和二氧化硫在水溶液中发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:![]() ,反应中被氧化的元素是S元素,化合价
,反应中被氧化的元素是S元素,化合价![]() 价变化为
价变化为![]() 价,电子转移总数
价,电子转移总数![]() ,标出电子转移的方向和数目为
,标出电子转移的方向和数目为![]()
故答案为:![]() ;S;
;S;
(4)电解饱和食盐水溶液中氯离子在阳极失电子被氧化生成氯气,氢离子在阴极得到电子生成氢气被还原,水电离平衡正向进行,溶液中氢氧根离子浓度增大溶液中生成氢氧化钠,
故答案为:![]() ;NaOH。
;NaOH。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,体积均为100 mL、浓度均为0.1 mol·L-1的两种一元碱MOH和ROH的溶液中,分别通入HCl气体,lg[c(OH-)/c(H+)]随通入HCl的物质的量的变化如图所示。下列有关说法中不正确的是(不考虑溶液体积的变化)
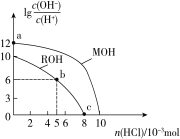
A. a点由水电离产生的c(H+)和c(OH-)的乘积=1×10-26
B. b点溶液中:c(Cl-)>c(R+)>c(H+)>c(OH-)
C. c点溶液溶液的pH=7,且所含溶质为ROH和RCl
D. 碱性:MOH>ROH,且MOH是强碱,ROH是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水晒盐的母液中提取金属镁的一种工艺流程如下:
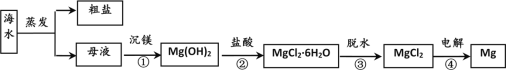
下列说法不正确的是
A. 步骤① 沉镁可加入石灰乳,说明Mg(OH)2的溶解度更小
B. 步骤③ 脱水时,在空气中加热MgCl2·6H2O得到MgCl2
C. 步骤④ 电解熔融MgCl2时,阴极有金属Mg析出
D. 设计步骤① 、② 、③ 的主要目的是富集镁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·yH2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液,溶液中c(Fe2+)=0.5mol/L。
②量取10.00mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积为20.00mL。所发生反应的离子方程式如下:4H++5Fe2++MnO=5Fe3++Mn2++4H2O
请回答下列问题:
(1)(NH4)xFe(SO4)2·yH2O中x=______,y=______。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有______;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是______。
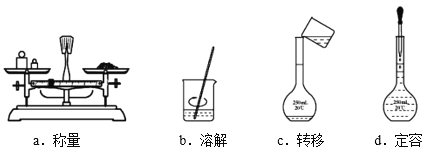
(3)KMnO4溶液的物质的量浓度c(KMnO4)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件一定能使反应速率加快的是
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积
④加入生成物 ⑤加入MnO2
A. 全部 B. ①②⑤ C. ② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.非金属元素既可以形成阴离子,也可以形成阳离子
B.金属元素只能形成阳离子
C.互为同分异构体的两种物质物理性质不同,但化学性质相同
D.单原子核阳离子,其最外层均具有2电子或8电子的结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
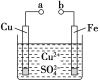
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25.00mL 0.1mol·L-1 HSCN溶液中滴入0.1 mol·L-1 NaOH溶液,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法正确的是

A. 常温下,Ka(HSCN)约为1×10-3
B. b=25.00
C. R、Q两点溶液对应的pH=7
D. N点溶液中:c(Na+)<c(SCN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向含有下列离子的溶液中加入少量SO3固体后,原溶液中离子的数目不变的是(提示:SO3+H2O=H2SO4)( )。
A.Mg2+B.![]() C.Ba2+D.OH-
C.Ba2+D.OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com