
 A、B、C三种固体物质的溶解度曲线如图所示.
A、B、C三种固体物质的溶解度曲线如图所示.分析 溶解度的概念是在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度.
(1)由图可知在t1℃时,A与C的溶解度都为25g,则溶解度相等,B的溶解度为40g,则B的溶解度最大;在相同温度,溶解度越大,饱和溶液的溶质质量分数越大;
(2)t1℃时,25gC在100g水中已是饱和溶液,C的溶解度随温度升高而降低,则t2℃时,C有晶体析出,仍是饱和溶液;A、B的溶解度随温度升高而增大,转化为不饱和溶液的方法有降低温度、增加溶剂.
解答 解:溶解度的概念是在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度.
(1)由图可知在t1℃时,A与C的溶解度都为25g,则溶解度相等,B的溶解度为40g,则B的溶解度最大;在相同温度,溶解度越大,饱和溶液的溶质质量分数越大;
故答案为:B>A=C;B;
(2)t1℃时,25gA和C分别在100g水中已是饱和溶液,B未达饱和,从图中得出A、B的溶解度随温度升高而增大,C的溶解度随温度升高而降低,则t2℃时,C有晶体析出,仍是饱和溶液,A、B是不饱和溶液;A、B的溶解度随温度升高而增大,转化为不饱和溶液的方法有降低温度、增加溶剂,
故答案为:C;降低温度;增加溶剂.
点评 本题考查溶解度曲线表示的意义及固体溶解度的概念,培养学生对概念的理解能力和应用能力,难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
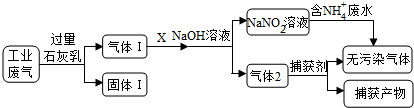
| A. | 固体Ⅰ中主要含有Ca(OH)2、CaCO3、CaSO3 | |
| B. | X可以是空气,且需过量 | |
| C. | 捕获剂所捕获的气体主要是CO | |
| D. | 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
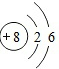 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,X属于共价化合物.
,X属于共价化合物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
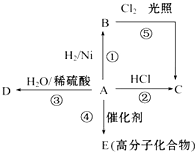 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
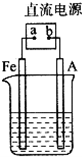 某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:
某地区常下酸雨,因而使金属制品锈蚀严重,铁制品镀铜可以有效防止铁的锈蚀,右图所示为铁制品镀铜的过程,请据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com