
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如图:
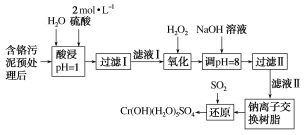
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
③Cr(OH)(H2O)5SO4是难溶物。
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ | |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
(1)实验室用18.4mol·L-1的浓硫酸配制480 mL2mol·L-1的硫酸,需要量取浓硫酸___mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为___(填微粒的化学式)。
(4)钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有___。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:__。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是___(填编号),滴定终点的现象是___。
A.NaCl B.K2CrO4 C.KI D.NaCN
【答案】54.3 500mL容量瓶、胶头滴管 2Cr3++3H2O2+H2O=Cr2O72-+8H+ CrO42- Mg2+、Ca2+ 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH- B 当滴入最后一滴标准液时,出现砖红色沉淀,且半分钟内沉淀颜色不改变
【解析】
(1)根据大而近的原则,选用容量瓶的规格,再进行计算;
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,而确定反应物及生成物再配平;
(3)根据2CrO42-+2H+Cr2O72-+H2O,利用勒夏特列原理确定;
(4)对调节pH=8后,溶液中的阳离子进行树脂交换;
(5)SO2与CrO42-反应生成Cr(OH)(H2O)5SO4和SO42-,确定反应主体,再配平氧化还原反应;
(6)根据Ksp大小及现象确定指示剂。
(1)配制480 mL2mol·L-1的硫酸时,应选用500mL的容量瓶,配制完成后再量取480mL溶液;根据c1×V1=c2×V2,V1=c2×V2/c1=2mol·L-1×0.5L/18.4mol·L-1=54.3mL;
(2)双氧水具有强氧化性,H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,反应物为Cr3+、H2O2和水,生成物为Cr2O72-和H+,利用化合价升降法配平,离子方程式为2Cr3++3H2O2+H2O=Cr2O72-+8H+;
(3)已知2CrO42-+2H+Cr2O72-+H2O,加入NaOH溶液时,碱性增强,消耗氢离子,生成CrO42-;
(4)调节pH=8时,根据溶液的pH表,除去溶液中的Fe3+、Al3+,溶液中阳离子仍旧剩余Mg2+、Ca2+,利用钠离子交换树脂可除去Mg2+、Ca2+;
(5)根据流程可知,SO2与CrO42-反应生成Cr(OH)(H2O)5SO4和SO42-,根据反应特点,反应物还有水,利用化合价升降法配平、补充缺少项,离子方程式为2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42-+2OH-;
(6)A.选用NaCl作指示剂时,多滴加一滴硝酸银溶液时,产生白色的氯化银沉淀,与AgSCN现象相同,无法判断终点,A错误;
B.K2CrO4作指示剂,Ksp(Ag2CrO4)>Ksp(AgSCN),多滴加一滴硝酸银溶液时,SCN-已沉淀完全,则立即产生砖红色沉淀,可判断滴定终点,B正确;
C.KI作指示剂,Ksp(AgSCN)>Ksp(AgI),滴加硝酸银时,先生成AgI沉淀,无法判断滴定终点,C错误;
D.NaCN作指示剂,Ksp(AgSCN)>Ksp(AgCN),滴加硝酸银时,先生成AgCN沉淀,且均为白色沉淀,无法判断滴定终点,D错误;
答案为B。
根据以上分析可知滴定终点时,当滴入最后一滴标准液时,出现砖红色沉淀,且半分钟内沉淀颜色不改变。


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】将Ca(OH)2、NaAlO2、NaOH配成100.0mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如图所示,下列说法中正确的是( )
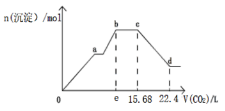
A. 混合溶液中c(NaOH)+c(NaAlO2)=0.4mol/L
B. e点的值为11.2
C. cd段表示Al(OH)3沉淀溶解
D. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的一种重要手段,现有图所示A-G七种仪器,请根据要求填空。

(I)写出仪器名称:F_________。
(II)下列实验操作中用到仪器G的是_______(选填下列选项的编号字母)。
a.分离水和CC14的混合物b.分离水和酒精的混合物c.分离水和泥砂的混合物
(III)配制480mL、0.2molL-1CuSO4溶液。
(1)应用托盘天平称取CuSO45H2O晶体____________,
(2)使用容量瓶前必须进行的一步操作是________,在容量瓶上需标记的是____________(填字母),
a.温度b.刻度线c.浓度d.容积
(3)所需仪器除了烧杯、玻璃棒、托盘天平外,还缺少__________________,
(4)实验中两次用到玻璃棒,起作用分别是____________、____________。
(5)配制溶液时除了称量、溶解、冷却、转移溶液、摇匀操作外,还缺少:__________________(填操作名称)。
(6)若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
a.胆矾失去了部分结晶水____________;
b.定容时加水超过刻度线____________;
c.最终定容时仰视观察液面____________;
d.容量瓶不干燥,含有少量蒸馏水____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H—Cl键的同时生成4 mol H—O键
D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是SO2(g)和O2(g)反应生成SO3(g)的能量变化示意图,由图可知( )
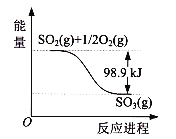
A. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= -197.8 kJ/mol
2 SO3(g) △H= -197.8 kJ/mol
B. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= +197.8 kJ/mol
2 SO3(g) △H= +197.8 kJ/mol
C. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= +98.9 kJ/mol
2 SO3(g) △H= +98.9 kJ/mol
D. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= -98.9 kJ/mol
2 SO3(g) △H= -98.9 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学知识回答下列问题:
(1)AlCl3溶液呈______性(填“酸”“中”“碱”)原因是_________________________(用离子方程式表示);若把AlCl3溶液蒸干,灼烧,最后主要得到固体产物是________;若将AlCl3溶液和NaHCO3溶液混合,该反应的离子方程式为__________________________________________。
(2)将1L0.2 mol·L-1HA溶液与1L0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同)。
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(3)常温下,若NaOH溶液中c(OH—)与NH4Cl溶液中c(H+)相同,现将NaOH溶液和NH4Cl溶液分别稀释10倍,稀释后NaOH溶液和NH4CI溶液的pH分别用pH1和pH2表示。则pH1 +pH2________(填“>”“<”或“=”)14。
(4)pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A.碳酸氢钙溶液跟盐酸反应:HCO3-+H+=H2O+CO2↑
B.氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-
C.碳酸氢钠溶液和氢氧化钙溶液混合HCO3-+OH-=CO32-+H2O
D.碳酸钠溶液中滴加少量盐酸CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为VL的固定容积的容器中发生反应:A(g)+B(g)![]() 3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
3C(g)(正反应为放热反应)下列说法能说明该反应已经达到平衡状态的是( )
①单位时间内生成C的分子数与分解C的分子数相等②外界条件不变时,ABC的浓度不随时间变化③体系温度不再变化④体系的分子总数不再变化 ⑤反应速率3v(B)=v(C)
A.①②B.①②③
C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )

A.FeCl3溶液、Fe(OH)3胶体与Fe(OH)3沉淀的本质区别是有没有丁达尔效应
B.将NaOH溶液与FeCl3溶液混合可制成Fe(OH)3胶体
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.胶体、分散系、混合物概念间的从属关系可用如图表示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com