
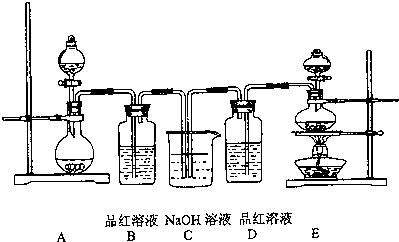
·ÖĪö £Ø1£©ŹµŃéŹŅÓĆE×°ÖĆÖĘČ”ĀČĘųµÄ·“Ó¦·½³ĢŹ½ĪŖ£ŗMnO2+4HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2O£¬øł¾ŻĀČŌŖĖŲµÄ»ÆŗĻ¼ŪÅŠ¶ĻĘä±ķĻֵĊŌÖŹ£»
£Ø2£©¶žŃõ»ÆĮņÄܹ»ÓėÓŠ»śÉ«ĖŲ»ÆŗĻ³ÉĪŽÉ«ĪļÖŹŹ¹Ę·ŗģČÜŅŗĶŹÉ«£¬µ«ŹĒøĆĪŽÉ«ĪļÖŹ²»ĪČ¶ØŹÜČČŅ×»Öø“ŌÉ«£¬ĀČĘųČÜŅŗĖ®Éś³ÉµÄ“ĪĀČĖį¾ßÓŠĒæµÄŃõ»ÆŠŌ£¬Ö±½Ó½«ÓŠÉ«ĪļÖŹŃõ»Æ³ÉĪČ¶ØµÄĪŽÉ«ĪļÖŹ£¬ŹÜČČ²»»Öø“ŃÕÉ«£»
£Ø3£©¶žŃõ»ÆĮņŗĶĀČĘų¶¼ŹĒÓŠ¶¾ĘųĢ壬ŠčŅŖ½ųŠŠĪ²Ęų“¦Ąķ£¬ŅŌĆāĪŪČ¾æÕĘų£»
£Ø4£©ĀČĘųÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘÓėĖ®£®
½ā“š ½ā£ŗ£Ø1£©ŹµŃéŹŅÖĘČ”ĀČĘųµÄ·“Ó¦·½³ĢŹ½ĪŖ£ŗMnO2+4HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$MnCl2+Cl2”ü+2H2O£¬ÓÉHClÉś³ÉMnCl2£¬ĀČŌŖĖŲ»ÆŗĻ¼Ū²»±ä£¬ÓÉHClÉś³ÉCl2£¬ĀČŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬ĖłŅŌÅØŃĪĖįĖł±ķĻÖ³öµÄŠŌÖŹŹĒĖįŠŌŗĶ»¹ŌŠŌ£¬
¹Ź“š°øĪŖ£ŗ»¹ŌŠŌŗĶĖįŠŌ£»
£Ø2£©¶žŃõ»ÆĮņÄܹ»ÓėÓŠ»śÉ«ĖŲ»ÆŗĻ³ÉĪŽÉ«ĪļÖŹŹ¹Ę·ŗģČÜŅŗĶŹÉ«£¬µ«ŹĒøĆĪŽÉ«ĪļÖŹ²»ĪČ¶ØŹÜČČŅ×»Öø“ŗģÉ«£¬ĀČĘųČÜŅŗĖ®Éś³ÉµÄ“ĪĀČĖį¾ßÓŠĒæµÄŃõ»ÆŠŌ£¬Ö±½Ó½«ÓŠÉ«ĪļÖŹŃõ»Æ³ÉĪČ¶ØµÄĪŽÉ«ĪļÖŹ£¬ŹÜČČ²»»Öø“ŃÕÉ«£¬
¹Ź“š°øĪŖ£ŗČÜŅŗÓÉĪŽÉ«±ä³ÉŗģÉ«£»ČÜŅŗČŌĪŖĪŽÉ«£»
£Ø3£©ĀČĘųŗĶ¶žŃõ»ÆĮņÓŠ¶¾£¬²»ÄÜÅŷŵ½æÕĘųÖŠ£¬ĀČĘųŗĶ¶žŃõ»ÆĮņ¶¼ŗĶ¼ī·“Ó¦£¬ĖłŅŌ×°ÖĆCµÄ×÷ÓĆ£ŗĪüŹÕ¶ąÓąµÄSO2ŗĶCl2£¬·ĄÖ¹ĪŪČ¾»·¾³£¬
¹Ź“š°øĪŖ£ŗĪüŹÕ¶ąÓąµÄSO2ŗĶCl2£¬·ĄÖ¹ĪŪČ¾»·¾³£»
£Ø4£©ĀČĘųÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ӧɜ³ÉĀČ»ÆÄĘ”¢“ĪĀČĖįÄĘÓėĖ®£¬·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗCl2+2OH-ØTCl-+ClO-+H2O£¬
¹Ź“š°øĪŖ£ŗCl2+2OH-ØTCl-+ClO-+H2O£®
µćĘĄ ±¾Ģāæ¼²éĘųĢåÖʱøÓėŠŌÖŹŹµŃ飬Éę¼°¶Ō×°ÖƵķÖĪöĘĄ¼Ū”¢SO2ŗĶHClOµÄĘư׊Ō”¢Ńõ»Æ»¹Ō·“Ó¦µČ£¬ÄŃ¶Č²»“ó£¬×¢Ņā¶Ō»ł“”ÖŖŹ¶µÄĄķ½āÕĘĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ijČÜŅŗĖ®µēĄėµÄc£ØH+£©•c£ØOH-£©=10-24 | B£® | c£ØH+£©=10-12mol/LµÄČÜŅŗ | ||
| C£® | ¼×»ł³Č³Ź»ĘÉ«µÄČÜŅŗ | D£® | ijČÜŅŗÓėAl·Ū·“Ó¦²śÉśĒāĘų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
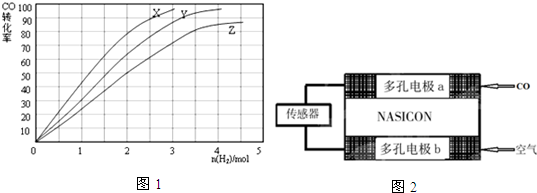
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £¬ŹµŃéÖŠ£¬æÉŅŌ¹Ū²ģµ½·“Ó¦¢ŚµÄĻÖĻóŹĒ£ŗĘųĢåÓÉĪŽÉ«±äŗģ×ŲÉ«£®
£¬ŹµŃéÖŠ£¬æÉŅŌ¹Ū²ģµ½·“Ó¦¢ŚµÄĻÖĻóŹĒ£ŗĘųĢåÓÉĪŽÉ«±äŗģ×ŲÉ«£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | Ķ¼aÖŠ£¬Ėę×ŵē½āµÄ½ųŠŠ£¬ČÜŅŗÖŠc£ØH+£©Ōö“ó | |
| B£® | Ķ¼bÖŠ£¬Mgµē¼«×öµē³Ųøŗ¼« | |
| C£® | Ķ¼cÖŠ£¬·¢ÉśµÄ·“Ó¦ĪŖCo+Cd2+=Cd+Co2+ | |
| D£® | Ķ¼dÖŠ£¬K·Ö±šÓėM”¢NĮ¬½Ó£¬Feµē¼«¾łŹÜµ½±£»¤ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Al3+ Mg2+ I- SO32- | B£® | Mg2+ Na+ CO32- I- | ||
| C£® | Al3+Na+ SO32- I- | D£® | Na+ CO32- Br-I- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©·“Ó¦¹ż³ĢµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£®
2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©·“Ó¦¹ż³ĢµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com