
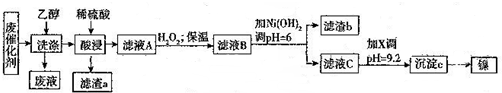
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
分析 用乙醇洗涤溶解并除去有机物杂质,“酸浸”时主要是溶解镍金属和铁、Al单质,只有SiO2不与硫酸反应,过滤得到滤渣a是SiO2;滤液A加入H2O2的目的是将Fe2+氧化为Fe3+,B溶液调节pH=6,使溶液中Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,通过过滤而除去,由表中数据,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质;Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,如通过铝热反应.
(1)利用蒸馏的方法可将乙醇与其它有机物分离开;
(2)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度均可提高酸浸速率;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+.由表中数据及流程图知,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质;
(4)Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,可以通过铝热反应进行;
计算m kg废催化剂中含镍的质量,计算滤液B中的镍元素质量,根据化学式计算Ni(OH)2中含镍的质量,将每一步的损失率都转化为Ni的损失率,根据Ni元素守恒计算最终得到的单质镍;
(5)首先依得失电子守恒配平氧化剂与还原剂、氧化产物与还原产物的计量数得:2Ni2++H2PO2-→2Ni++H2PO3-+,再依电荷守恒、质量守恒知还有水参与反应并有H+生成;
从能源消耗方面分析化学镀的优点.
解答 解:用乙醇洗涤溶解并除去有机物杂质,“酸浸”时主要是溶解镍金属和铁、Al单质,只有SiO2不与硫酸反应,过滤得到滤渣a是SiO2.滤液A加入H2O2的目的是将Fe2+氧化为Fe3+,B溶液调节pH=6,使溶液中Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,通过过滤而除去,由表中数据,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质.Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,如通过铝热反应.
(1)用乙醇洗涤的目的是溶解并除去有机物杂质,利用蒸馏的方法可将乙醇与其它有机物分离开;因只有SiO2不与硫酸反应,故滤渣a是SiO2,
故答案为:SiO2;溶解、除去有机物;蒸馏;
(2)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度均可提高酸浸速率,
故答案为:将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,由表中数据及流程图知,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质,X可以为NaOH,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;NaOH;
(4)Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,可以通过铝热反应进行,反应方程式为:Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni;
m kg废催化剂中含镍的质量为70% m kg,在经过洗涤及酸浸转化到滤液B中的镍元素为70%×97% m kg,a kg Ni(OH)2中含镍为$\frac{59}{93}$a kg,根据Ni元素守恒,故最终得到的单质镍为(70%×97%m+$\frac{59}{93}$a)kg×95%,
故答案为:(70%×97%m+$\frac{59}{93}$a)×95%;
(5)首先依得失电子守恒配平氧化剂与还原剂、氧化产物与还原产物的计量数得:2Ni2++H2PO2-→2Ni++H2PO3-+,再依电荷守恒、质量守恒知还有水参与反应并有H+生成,配平后的离子方程式为:2Ni2++H2PO2-+H2O=2Ni++1H2PO3-+2H+;
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源,
故答案为:2、1、H2O→2、1、2H+;不消耗电能,节约能源.
点评 本题以工艺流程为载体,考查了物质分离提纯、化学反应速率影响因素、沉淀转化、化学计算、氧化还原反应配平等,是高考常考题型,综合性较强,涉及知识面较广,侧重考查学生对知识的迁移应用,关键是对工艺流程理解分析,难度中等.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 mol/L NaOH的溶液 | B. | 2 mol/L Na2SO4的溶液 | ||
| C. | 2 mol/L MgSO4的溶液 | D. | FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 0.89 | 0.82 | 0.77 | 0.99 | 0.75 | 1.17 | 1.43 |
| 最高或最低化合价 | +2 | +3 | +4 | +7 | +5 | +4 | +3 | |
| -2 | -4 | -1 | -3 | -4 |

 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
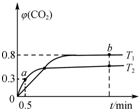 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}Cl$ | B. | 四氯化碳的电子式: | ||
| C. | 铝原子的结构示意图: | D. | 二氧化碳的结构式:O-C-O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 | |
| B. | 向淀粉溶液中加入稀H2SO4,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解 | |
| C. | 将蔗糖和稀H2SO4加热水解后的液体取出少许,加入新制的Cu(OH)2并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖 | |
| D. | 蛋白质溶液中加入丙酮可以使蛋白质从溶液中析出,再加水又能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com