
分析 由于Na与水反应生成氢气,故无论HCl是否足量,Na都完全反应生成氢气,根据2Na~H2↑计算Na生成氢气气体物质的量;
HCl的物质的量为0.01L×1mol/L=0.01mol,由Mg+2HCl=MgCl2+H2↑,Al+6HCl=2AlCl3+3H2↑,可知HCl不足量,根据HCl可知二者生成氢气体积相等,根据H原子守恒计算生成氢气物质的量.
解答 解:由于Na与水反应生成氢气,故无论HCl是否足量,Na都完全反应生成氢气,根据2Na~H2↑可知,Na生成氢气气体物质的量为$\frac{0.2mol}{2}$=0.1mol;
HCl的物质的量为0.01L×1mol/L=0.01mol,由Mg+2HCl=MgCl2+H2↑,Al+6HCl=2AlCl3+3H2↑,可知HCl不足量,根据HCl可知二者生成氢气体积相等,根据H原子守恒,而生成氢气物质的量为$\frac{0.01mol}{2}$=0.005mol,
故标准状况下产生氢气的体积大小顺序是:Na>Mg=Al,
故答案为:Na>Mg=Al.
点评 本题考查化学方程式计算,涉及过量计算,难度不大,注意Na能与水反应生成氢气.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | |
| B. | 胶体能产生丁达尔现象 | |
| C. | 胶体粒子直径在10-9~10-7 m之间 | |
| D. | 胶体是纯净物,其它分散系是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
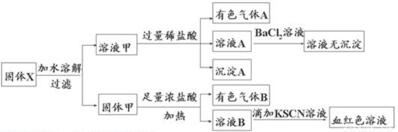
| A. | 溶液甲中一定含有K2SO3、NaNO2 | B. | 无法判断溶液中是否有K2SO3 | ||
| C. | 气体A和气体B-定为混合物 | D. | 原混合物中一定有Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量浓度的三种溶液的pH:a=b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a=b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
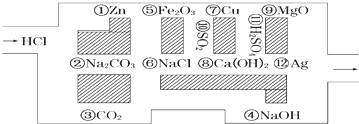
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
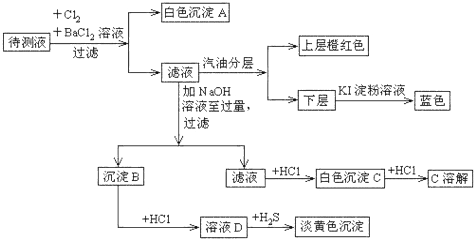
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中:K+、Cl-、HCO3-、Na+ | |
| B. | 在[H+]=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| D. | 使石蕊试液变红的溶液:K+、MnO4-、I-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com