
分析 X、Y、Z和W均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,则X是H元素;Y原子最外层电子数是其周期数的三倍,最外层电子数不超过8个,第一电子层为最外层不超过2个,则Y是O元素;Z与X原子最外层电子数相同,且原子序数大于Y,则Z为Na元素;W的最外层电子数等于X、Y、Z最外层电子数之和的$\frac{3}{4}$,则W的最外层电子数为:(1+6+1)×$\frac{3}{4}$=6,W的原子序数大于Na,且为短周期元素,则W为S元素,据此结合元素周期律知识进行解答.
解答 解:X的单质为密度最小的气体,则X是H元素;Y原子最外层电子数是其周期数的三倍,最外层电子数不超过8个,第一电子层为最外层不超过2个,则Y是O元素;Z与X原子最外层电子数相同,且原子序数大于Y,则Z为Na元素;W的最外层电子数等于X、Y、Z最外层电子数之和的$\frac{3}{4}$,则W的最外层电子数为:(1+6+1)×$\frac{3}{4}$=6,W的原子序数大于Na,且为短周期元素,则W为S元素,
(1)电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则X、Y、Z和W四种元素中原子半径由大到小的顺序是:Na>S>O>H,
故答案为:Na>S>O>H;
(2)Z与X分别为Na、X为H元素,二者形成化合物为NaH,NaH为离子化合物,其电子式为Na+[:H]-,
故答案为:Na+[:H]-;
(3)由X、Y和Z分别为H、O、Na,由H、O、Na三种元素中任意几种组成的各化合物中,既含有共价键又含有离子键的化合物的化学式为:NaOH、Na2O2,
故答案为:NaOH;Na2O2;
(4)Y和W分别为O、S,其氢化物分别为H2O、H2S,由于水分子中含有氢键,则水的沸点大于硫化氢,所以沸点大小关系为:H2O>H2S,
故答案为:H2O>H2S;
(5)X与Y形成的既含有极性共价键又含有非极性共价键的化合物在酸性条件下与高锰酸钾反应,该化合物为H2O2,二者反应的离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑;
双氧水具有氧化性,H2O2还可将碱性工业废水中的CN-氧化为碳酸盐和氨,反应的离子方程式为:H2O2+CN-+OH-=CO32-+NH3↑,
故答案为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑;H2O2+CN-+OH-=CO32-+NH3↑.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系,(4)为易错点,注意氢键对化合物熔沸点的影响,试题培养了学生的灵活应用能力.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA | |
| C. | 92 g NO2和N2O4混合气体中含有氧原子总数为4NA | |
| D. | 标况下,22.4升SO3含有原子总数为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
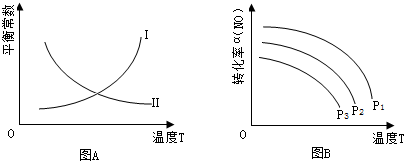
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5molCO2、1.5molH2,平衡时CO2的转化率小于75% | |
| D. | 12min时,向上述容器中再充入0.25molCO2、0.25molH2O(g),此时反应将向逆反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
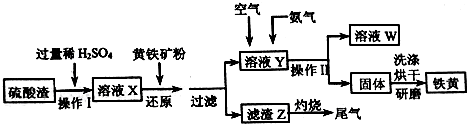
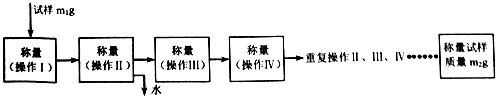
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com