
| A. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,先用盐酸酸化 |
分析 A.水解后检验氯离子,利用硝酸酸化;
B.高锰酸钾可氧化氯离子;
C.亚铁离子与硝酸发生氧化还原反应;
D.先加盐酸排除干扰离子,再加氯化钡可检验硫酸根离子.
解答 解:A.水解后检验氯离子,利用硝酸银检验氯离子时利用硝酸酸化,而硫酸与硝酸银反应生成沉淀干扰离子的检验,故A错误;
B.高锰酸钾可氧化氯离子,不能利用盐酸酸化,应利用硫酸,故B错误;
C.亚铁离子与硝酸发生氧化还原反应,不能抑制水解,应加盐酸或稀硫酸,故C错误;
D.先加盐酸排除干扰离子,再加氯化钡可检验硫酸根离子,则检验溶液中是否含有SO42-时,先用盐酸酸化,故D正确;
故选D.
点评 本题考查实验方案的评价,为高频考点,把握物质的性质、发生的反应及离子检验方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
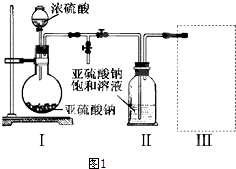
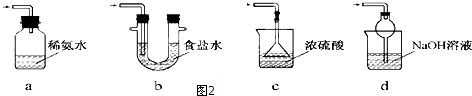

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻黄碱适应于医治因葡萄球菌和链球菌引起的血毒症 | |
| B. | 胃酸过多,出现反胃、吐酸等现象时,可服用小苏打 | |
| C. | 感冒发热头痛时,服用阿司匹林 | |
| D. | 因葡萄球菌等引起的发炎,注射青霉素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
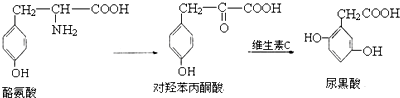
| A. | 1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应 | |
| B. | 酪氨酸能发生加成、取代、消去和缩聚反应 | |
| C. | 1mol对羟苯丙酮酸最多可与5molH2反应 | |
| D. | 1mol尿黑酸最多可与3molBr2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 氧化性:Cl2>S | C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 荧光蛋白是一种高分子化合物且能发生水解 | |
| B. | 用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 | |
| C. | 利用次氯酸钠溶液的碱性对餐具和环境消毒 | |
| D. | 大量排放PM2.5、SO2、NOX等会形成雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA | |
| B. | 常温下,46 g分子式为C2H6O的物质中一定含有极性键为7NA,非极性键为NA | |
| C. | 125 mL 16 mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA | |
| D. | 标准状况下,体积为22.4 L NO2、N2O4的混合气体,升温至常温,则混合气体分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com