
| A. | 1 mol NH 5 中含有5N A 个NH键(N A 表示阿伏加德罗常数) | |
| B. | NH 5 中既有共价键又有离子键,它形成的晶体是离子晶体 | |
| C. | NH 5的电子式为: | |
| D. | 它与水反应的化学方程式为:NH 5+H 2O═NH 3H 2O+H 2↑ |
分析 固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,应为NH4H,分子中存在NH4+和H-,为离子化合物.
解答 解:A.NH5为离子化合物,为NH4H,1molNH5中含有4NA个N-H键,故A错误;
B.NH5中存在NH4+和H-,为离子化合物,含有离子键,N-H键共价键,它形成的晶体是离子晶体,故B正确;
C.NH5中存在NH4+和H-,为离子化合物,电子式为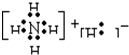 ,故C错误;
,故C错误;
D.它与H2O反应,H-具有还原性,H2O具有氧化性,可生成氨气和氢气,反应的方程式为NH5+H2O═NH3•H2O+H2↑,故D正确.
故选AC.
点评 本题考查离子混合物的组成和性质,题目难度不大,注意根据题给信息判断化合物的类型.


科目:高中化学 来源: 题型:选择题
| A. | 蚕食被中含有的蚕丝 | B. | 大豆油、猪油中含有的油脂 | ||
| C. | 五谷杂粮中含有的淀粉 | D. | 棉质衣服中的纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷所含分子数为0.1 NA | |
| B. | 78gNa2O2固体与足量的H2O反应转移的电子数为0.5NA | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 2.0gH218O和D216O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 向 0.10 mol•L-1Na2SO3溶液中通 SO2 气体至溶液 pH=7:c(Na+)═2c(SO32-)+c(HSO3-) | |
| D. | 0.1 mol AgCl 和 0.1 mol AgBr 混合后加入水中,所得溶液 c(Cl-)═c(Br-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com