
| A. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| B. | 空气中直径小于或等于2.5?m的颗粒物称为PM2.5 | |
| C. | pH<7的雨水称为酸雨,对环境造成很大的危害 | |
| D. | 甲醛的水溶液可以作为鱿鱼等海鲜的防腐剂 |
科目:高中化学 来源: 题型:解答题
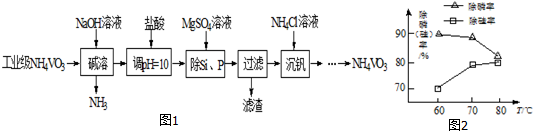
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的正极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 两种气体的原子个数之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的体积之比为17:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏水 | B. | 0.5 mol/L的醋酸溶液 | ||
| C. | 0.5 mol/L的盐酸 | D. | 0.5 mol/L的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.6% | B. | 27% | C. | 10% | D. | 73% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
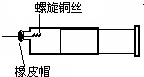 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
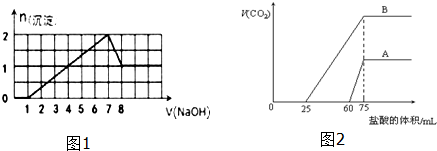
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com